
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химическая связь в комплексных соединениях
|
|
Для объяснения образования и свойств комплексных соединений в настоящее время применяется теория валентных связей (ВС), теория кристаллического поля (ТКП) и теория молекулярных орбиталей (МО). Мы ограничимся методом ВС.
Теория ВС для комплексных соединений. Пространственная структура комплексных частиц может быть объяснена с позиций метода валентных связей (ВС). Согласно этому методу связь между центральным атомом и лигандами образуется за счет донорно-акцепторного взаимодействия: лиганд - донор, а центральный атом - акцептор электронной пары. При этом ковалентная s-связь образуется в результате перекрывания вакантной орбитали центрального атома или иона комплексообразователя с заполненными, т. е. содержащими неподеленные пары электронов, орбиталями лигандов. Максимально возможное число s-связей определяет координационное число комплексообразователя. Поскольку при одинаковых лигандах образующиеся s-связи равноценны, то образование комплексной частицы сопровождается гибридизацией акцепторных орбиталей комплексообразователя. Критерием для определения типа гибридизации могут служить опытные данные о магнитных свойствах образующихся комплексов.
Пример 15. Определить пространственную структуру и устойчивость комплексных ионов: а) парамагнитного [CoF6]3-; б) диамагнитного [Co(NH3)6]3+.
Решение. а) [CoF6]3- - координационное число Co равно шести, степень окисления (w) Co = +3; электронное строение атома Co -…3 d 74 s 2, иона Co3+ -....3 d 64s04 p 04 d 0; для F -..2 s 22 p 5, для иона F- -.. 2 s 22 p 6.
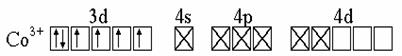
(Крестомобозначена неподеленная пара электронов от лиганда - иона F-).
Из показанной схемы ВС следуют выводы:
• Co3+ - акцептор шести электронных пар;
• АО Co3+ гибридизованы, тип гибридизации sp3d2 – октаэдрический;
• комплекс имеет 4 неспаренных электрона, он парамагнитен;
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
• комплекс внешнеорбитальный, так как. в образовании донорно-акцепторных связей принимают участие внешние 4 d -АО (3 d -АО - внутренние орбитали). Использование внешних d -орбиталей требует затраты энергии, поэтому комплекс неустойчив.
б) [Co(NH3)6]3+ - координационное число Co равно шести, степень окисления
(w)Сo = +3. Электронное строение NH3 таково, что каждая молекула имеет неподеленную электронную пару, за счет которой эта молекула будет донором. Так как комплекс диамагнитен, то все шесть d -электронов спарены, поэтому схему ВС для этого комплекса можно изобразить так:
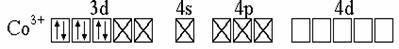
Из этой диаграммы следуют выводы:
• Co3+ - акцептор шести электронных пар;
• АО (Co3+) гибридизованы по типу d 2 sp 3 - они образуют октаэдр;
• комплекс диамагнитен, все электроны спарены;
• комплекс внутриорбитальный, так как акцепторами являются внутренние 3 d -атомные орбитали, он устойчивее, чем внешнеорбитальный.
Из приведенных примеров видны следующие особенности применения теории ВС к комплексам:
1. Для построения схемы ВС используются атомы и ионы с зарядом, соответствующим степени окисления.
2. Для образования химической связи не используются электроны центрального атома; используются лишь его пустые АО и электронные пары лигандов. (Однако возможен дополнительный учет дативного взаимодействия между парами d -электронов металла и пустыми, акцепторными, орбиталями лигандов).
3. Вопрос о расположении электронов на d -АО (и вопрос о магнитных свойствах) в теории ВС не решается, используются экспериментальные данные или данные других теорий (например, теория кристаллического поля - ТКП).
4. В методе ВС вопросы геометрии комплекса, гибридизации АО, устойчивости решаются по схемам ВС.
|
|
