
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Равновесие в растворах комплексных соединений
|
|
При диссоциации в растворах и многих химических реакциях комплекс сохраняется:
[Ni(NH3)4]SO4 ® [Ni(NH3)4]2+ + SO42-
[Ni(NH3)4]SO4 + BaCl2 = [Ni(NH3)4]Cl2 + BaSO4¯
Обычно комплексные соединения в растворах диссоциируют на внешнюю и внутреннюю координационные сферы практически полностью по типу сильных электролитов (первичная диссоциация). Комплексные соединения обладают различной прочностью внутренней координационной сферы. Наряду с соединениями, внутренняя сфера которых отличается значительной прочностью и для которых диссоциация ничтожно мала, существуют соединения с крайне непрочной внутренней сферой. Растворы этих соединений практически не содержат комплексных ионов, так как они полностью диссоциируют на свои составные части (двойные соли). Диссоциация внутренней координационной сферы носит название вторичной, является обратимым процессом и проходит по типу слабых электролитов. Момент наступления равновесия характеризуется константой равновесия, которая в случае комплексного иона носит название константы нестойкости (К Н).
Пример 14. Напишите процессы диссоциации и выражение для константы нестойкости комплексной соли К4[Fe(CN)6].
Решение. Если комплексная соль гексацианоферрат (III) калия, являясь сильным электролитом, в водном растворе практически полностью диссоциирует на ионы внешней и внутренней сфер:
K4[Fe(CN)6] = 4K+ + [Fe(CN)6]4-,
то комплексный ион диссоциирует в незначительной степени на составляющие его частицы:
[Fe(CN)6]4- ⇆ Fe2+ + 6CN-
Константа равновесия этой реакции в данном случае является константой нестойкости (КН) комплекса:
К Н 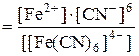 .
.
Значения констант нестойкости различных комплексных ионов колеблются в широких пределах и могут служить мерой устойчивости комплекса.
Чем меньше значение К н, тем более прочен данный комплекс.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Сравним, например, константы нестойкости и устойчивость ряда комплексов серебра: [Ag(NO2)2]-, [Ag(NH3)2]+, [Ag(S2O3)]3- и [Ag(CN)2]-. Для них К н: 1, 3·10-3 ; 5, 7·10-8; 2, 5·10-14 и 8, 0·10-21 соответственно. Следовательно, можно прийти к выводу, что наименее устойчивым из этих ионов является первый, а наиболее устойчивым - последний. Очевидно также, что при одной и той же молярной концентрации комплексного соединения концентрация ионов Аg+ будет больше в растворе первого соединения и меньше - в растворе последнего.
|
|
