
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Закон эквивалентов
|
|
Количественный подход к изучению химических явлений и установление закона постоянства состава показали, что вещества вступают во взаимодействие в определенных соотношениях масс, что привело к введению такого важного понятия, как “эквивалент”, и установлению закона эквивалентов.
Эквивалент - это частица или часть частицы, которая соединяется (взаимодействует) с одним атомом водорода или с одним электроном.
Из этого определения видно, что понятие “эквивалент” относится к конкретной химической реакции; если его относят к атому в химическом соединении, то имеют в виду реакцию образования этого соединения из соответствующего простого вещества и называют эквивалентом элемента в соединении.
В одной формульной единице вещества (В) может содержаться Zв эквивалентов этого вещества. Число Zв называют показателем эквивалентности.
Фактор эквивалентности (f) - доля частицы, составляющая эквивалент; f £ 1 и может быть равным 1, 1/2, 1/3 и т.д.
fВ = 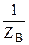 . (1.7)
. (1.7)
Масса 1 моль эквивалентов, выраженная в граммах, называется молярной эквивалентной массой (Мэк) (г/моль); численно она равна относительной молекулярной массе эквивалента (кратко ее называют эквивалентной массой).
Мэк = fВ·М. (1.8)
Закон эквивалентов: массы взаимодействующих без остатка веществ соотносятся как их эквивалентные массы. Математическое выражение закона эквивалентов:
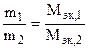 , (1.9)
, (1.9)
где Мэк, 1 и Мэк, 2 - эквивалентные массы.
Пример 8. Определить эквивалент и эквивалентную массу кислорода в Н2О.
Решение. Такая формулировка вопроса предполагает реакцию образования молекулы воды из кислорода и водорода:
H2 + ½ O2 = Н2О, то есть с 1 атомом водорода соединяется ½ атомов кислорода. Следовательно, Z(О) = 2. Масса 1 моль атомов кислорода равна 16 г, отсюда
Мэк(O) = М (О)· 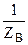 =
= 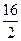 = 8 г/ моль.
= 8 г/ моль.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Эквиваленты одних и тех же элементов в различных химических соединениях могут различаться, так как величина эквивалента зависит от характера превращения, претерпеваемого им. Так, в соединении SO2 эквивалентная масса серы равна 8 г/моль, что составляет 1/4 от атомной массы, а в соединении SO3 - 5, 3 г/моль, что составляет 1/6 от атомной массы серы (ZS = 4 и 6, соответственно). Практический расчет эквивалентной массы элемента в соединении ведут по формуле
Мэк (элемента) = Аэк = 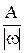 , (1.10)
, (1.10)
где А - атомная масса, ω - степень окисления элемента в данном соединении. (Ниже будет показано, что для реакции образования соединения из простых веществ ZВ = |ω |).
Например, ZВ (Mn) в соединении KMnO4 (ω = +7) составляет 7, а
Мэк (Mn) = = 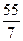 = 7, 85 г/моль; в соединении Mn2O3 (ω = +3) – ZВ = 3 и
= 7, 85 г/моль; в соединении Mn2O3 (ω = +3) – ZВ = 3 и
Мэк (Mn) = = 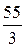 = 18, 3 г/моль. (55 - масса 1-го моля атомов марганца или атомная масса).
= 18, 3 г/моль. (55 - масса 1-го моля атомов марганца или атомная масса).
Эквивалентная масса вещества в химических реакциях имеет различные значения в зависимости от того, в каком взаимодействии это вещество участвует. Если во взаимодействии сложного вещества участвует его известное количество или известно количество реагирующих групп, то для расчета эквивалентных масс можно пользоваться следующими правилами и формулами.
а) Вещества друг с другом реагируют одинаковыми количествами эквивалентов. Например, в реакции
2Al + 3/2O2 = Al2O3
6 моль эквивалентов Al реагируют с таким же количеством кислорода
(ZВ (Al) = 3, ZВ (O) = 2).
б) Эквивалентная масса кислоты в реакциях замещения ионов водорода равна:
М эк. кислоты = 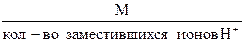 (1.11)
(1.11)
Пример 9. Определить эквивалент и эквивалентную массу H2SO4 в реакциях:
1) H2SO4 + KOH = KHSO4 + H2O;
2) H2SO4 + 2KOH = K2SO4 + 2H2O.
Решение. В первой реакции заместился один ион водорода, следовательно, эквивалент серной кислоты равен 1, ZВ (H2SO4) = 1, Мэк(H2SO4) = М× 1 = 98 г/моль. Во второй реакции заместились оба иона водорода, следовательно, эквивалент серной кислоты равен двум молям, ZВ (H2SO4) = 2, а Mэк (H2SO4) = 98·½ = 49 г/моль.
в) Эквивалентная масса основания в реакции замещения ионов гидроксила равна:
Мэк. основания = 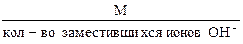 . (1.12)
. (1.12)
Пример 10. Определить эквивалент и эквивалентные массы гидроксида висмута в реакциях:
1) Bi(OH)3 + HCl = Bi(OH)2Cl + H2O;
2) Bi(OH)3 + 3HCl = BiCl3 + H2O.
Решение. 1)ZВ Bi(OH)3 = 1, Mэк Bi(OH)3 = 260 г/моль (т. к. из трех ионов гидроксила заместился один);
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
2) ZВ Bi(OH)3 = 3, a Mэк Bi(OH)3 = 260· 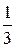 = 86, 3 г/моль (т. к. из трех ионов ОН- заместились все три).
= 86, 3 г/моль (т. к. из трех ионов ОН- заместились все три).
г) Эквивалентная масса соли в реакциях полного замещения катиона или аниона равна:
Мэк. соли = 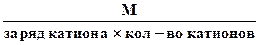
или (1.13)
Мэк соли = 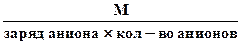 .
.
Так, ZВ Al2(SO4)3 = 3∙ 2 = 6. Однако в реакции эта величина может быть больше (неполное замещение) или меньше (комплексообразование). Если, например, это соединение участвует во взаимодействии по реакции
Al2(SO4)3 + 12KOH = 2K3[Al(OH)6] + 3K2SO4,
то при этом три аниона с суммарным зарядом 6 замещаются 12 ОН- ионами, следовательно, 12 эквивалентов этого вещества должно вступать в реакцию. Таким образом, ZВ Al2(SO4)3 = 12, а Мэк = М·fВ = 342/12 = 28, 5 г/моль.
д) Эквивалентная масса оксида в реакциях полного замещения равна:
Мэк оксида = 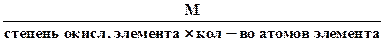 . (1.14)
. (1.14)
Например, ZВ (Fe2O3) = 3·2 = 6. Мэк = М(Fe2O3)·fВ = 160× 1/6 = 26, 6 г/моль. Однако в реакции
Fe2O3 + 4HCl = 2FeOHCl2 + H2O
ZВ (Fe2O3) = 4, Мэк = М(Fe2O3)∙ fВ = 160× 1/4 = 40 г/моль, так как Fe2O3 взаимодействует с четырьмя эквивалентами HCl (fВ = 1).
При решении задач, связанных с газообразными веществами, целесообразно пользоваться значением эквивалентного объема. Это объем, занимаемый одним молем эквивалентов газообразного вещества.
Пример 11. Рассчитайте эквивалентные объемы газообразных водорода и кислорода при н.у.
Решение. Для водорода при н.у. этот объем равен 11, 2 литров (молярный объем Н2 составляет 22, 4 л, а так как Мэк (Н) = 1г (т.е. в 2 раза меньше, чем молярная масса), то эквивалентный объем будет в 2 раза меньше молярного, т. е. 11, 2 л), для кислорода – 5, 6л ( молярный объем О2 составляет 22, 4 л, а так как Мэк (О) = 8г (т.е. в 4 раза меньше, чем молярная масса О2 ), то эквивалентный объем будет в 4 раза меньше, чем молярный.
Пример 12.  На восстановление 1, 80 г оксида металла израсходовано 883 мл водорода (н.у.). Вычислить эквивалентные массы оксида и металла.
На восстановление 1, 80 г оксида металла израсходовано 883 мл водорода (н.у.). Вычислить эквивалентные массы оксида и металла.
Решение. Согласно закону эквивалентов (1.9) массы (объемы) реагирующих веществ пропорциональны их эквивалентным массам (объемам):
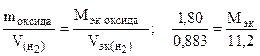 . Отсюда
. Отсюда
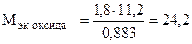 (г/моль);
(г/моль); 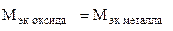 +
+ 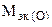 ,
,
тогда  г/моль.
г/моль.
Пример 13. Вычислить эквивалентную массу цинка, если 1, 168 г Zn вытеснили из кислоты 438 мл Н2 (t = 17 оС и Р = 750 мм рт. ст.).
Решение. Согласно закону эквивалентов (1.9): 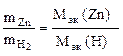 ;
;
Из уравнения Менделеева-Клапейрона (1.4):
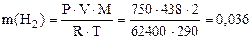 г,
г,
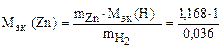 = 32, 6 г/моль.
= 32, 6 г/моль. 
д) Эквивалентная масса окислителя и восстановителя определяются делением молярной массы на изменение степени окисления в соответствующей реакции на 1моль.
Пример 14. Определить эквивалентные массы окислителя и восстановителя в реакции:
+6 +4 +3 +6
K2Cr2O7 + 3Na2SO3 + 4H2SO4 = Cr2(SO4)3 + 3Na2SO4 + K2SO4 + 4H2O.
Решение. Окислителем в этой реакции является K2Cr2O7, а восстановителем – Na2SO3. Суммарное изменение степени окисления хрома в K2Cr2O7 Dw(2Cr) = 2 . (+3) – 2 . (+6) = – 6; Поэтому
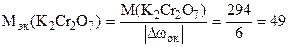 г/моль.
г/моль.
Суммарное изменение степени окисления серы в Na2SO3: Dw (S) = +6 – (+4) = +2;
Поэтому
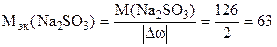 г/моль.
г/моль.
|
|
