
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Структурные формулы
|
|
В веществах (молекулярных, ионных, ковалентных, металлических) атомы связаны друг с другом в определённой последовательности, а между парами атомов (между химическими связями) имеются определённые углы. Всё это необходимо для характеристики веществ, так как от этого зависят их физические и химические свойства. Сведения о геометрии связей в веществах частично или полностью отражаются в структурных формулах. В этих формулах связь между атомами изображают чертой. Например,
H2O изображают так: H-O-H; Hg2Cl2: Cl-Hg-Hg-Cl;
HNO2: H-O-N=O.
При изображении структурных формул часто принимают, что электронная валентность совпадает со стехиометрической. Такие структурные формулы несут информацию о составе и порядке расположения атомов, но не содержат правильных сведений о связях.
Например, КNO3:
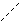
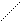

 O O
O O
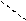

 К-O-N К+ [ O-N ]-
К-O-N К+ [ O-N ]-
 O O
O O
(неправильно) (правильно)
здесьV стх(N) = 5, однако Vē (N) = 4.
Структурные формулы, построенные по стехиометрическим валентностям (Vстх), иногда называются графическими.
Соединения, в которых у всех элементов Vстх действительно совпадает с электронной валентностью (V 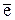 ) называют простыми соединениями; к ним относятся только некоторые молекулярные соединения (например, CO2, SO2, SO3, CH4, ClF3 и др.). Соединения, в которых это условие не выполняется, называются сложными. К ним относятся, например, все комплексные соединения, CO, H2O2, HNO3 и др.
) называют простыми соединениями; к ним относятся только некоторые молекулярные соединения (например, CO2, SO2, SO3, CH4, ClF3 и др.). Соединения, в которых это условие не выполняется, называются сложными. К ним относятся, например, все комплексные соединения, CO, H2O2, HNO3 и др.
Большинство оксидов, кислот, оснований и солей существуют в виде твердых или жидких соединений с частично ионными связями или в виде растворов, в которых соединения диссоциированы на ионы, и которые, в свою очередь, гидратированы. Поэтому даже при совпадении Vстх и V 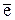 графические формулы не соответствуют структуре, а носят формальный, условный характер, показывая как могли бы соединяться атомы, если бы вещество состояло из молекул, соответствующих формуле. Истинную структурную формулу можно изобразить лишь на основании исследования реальной структуры вещества – экспериментально или теоретически (см. раздел учебников химии “Химическая связь”).
графические формулы не соответствуют структуре, а носят формальный, условный характер, показывая как могли бы соединяться атомы, если бы вещество состояло из молекул, соответствующих формуле. Истинную структурную формулу можно изобразить лишь на основании исследования реальной структуры вещества – экспериментально или теоретически (см. раздел учебников химии “Химическая связь”).
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
При изображении структурных (графических) формул нужно выполнять следующие простые правила:
1. Число чёрточек, исходящих от каждого атома, равно его валентности (Vстх = V 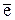 ).
).
2. В обычных кислотах и солях со сложным кислородсодержащим катионом атомы H и Me соединяются с кислотообразующим элементом через кислород


 H-O-Э, Мe-О-Э.
H-O-Э, Мe-О-Э.
 |
3. Одинаковые атомы не соединяются между собой, не образуют гомоцепей, они соединяются через атомы неметалла: a) CrO3; б) K2O; в) Al2S3.
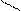
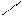
 O K S
O K S
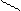

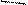 а) Cr; б) О, в) Al ¾ S ¾ Al или
а) Cr; б) О, в) Al ¾ S ¾ Al или

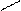
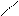
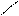 O O K S
O O K S
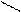
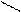 S
S

 Al-S-Al
Al-S-Al
S.
Правила нарушаются в " сложных " соединениях; например, пероксо- и персульфо- соединениях:
K ¾ S K ¾ O
K2S2: ½: K2O2: ½.
K ¾ S K ¾ O
Некоторые кислоты и соли фосфора также являются сложными соединениями:
H O
| ç ç
Кислоты: H3PO2: H-O-P = O, H3PO3: H-O-P - O -H.
| ç
H H
Из структурной формулы Н3РО2 видно, что только один атом водорода соединен через кислород с фосфором, поэтому основность этой кислоты равна 1, а основность Н3РО3 - 2.
Пример 14. Изобразить структурную формулу K2SO4.
Решение. Определяем стехиометрические валентности атомов: V(K) = 1; V(S) = 6;
V(O) = 2. Изображаем структурную формулу, пользуясь правилами 1÷ 3:


 K - O O Эта формула - графическая. На самом деле таких
K - O O Эта формула - графическая. На самом деле таких
 S молекул не существует (К2SО4 – формульная единица с
S молекул не существует (К2SО4 – формульная единица с


 K - O O ионной кристаллической решеткой твердого вещества).
K - O O ионной кристаллической решеткой твердого вещества).
Вприведенных примерах углы между связями взяты произвольно. Однако они также могут быть точно указаны и изображены.
Для графического изображения формул солей можно исходить из соответствующих формул кислот, заменяя в них атомы водорода на атомы металла с соблюдением правила валентности, т.е. один атом водорода заменяется одновалентным металлом, два - двухвалентным, три - трехвалентным и т.д. Например, графическое изображение формулы карбоната кальция (CaCO3) можно представить так:
карбонат кальция - это средняя соль угольной кислоты H2CO3:

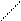
 Н-О О
Н-О О


 С=О Са С=О.
С=О Са С=О.
Н -О О
Пример 15. Изобразите графические формулы кислой соли гидросульфата натрия и основной соли карбоната гидроксожелеза (III).
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Решение. При составлении графических формул солей нужно отчетливо представлять себе графические формулы кислотных и основных остатков. Кислую соль (NaHSO4) можно представить как продукт замещения одного атома водорода в серной кислоте на атом натрия:

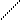



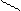 H-О O H-O O
H-О O H-O O
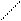



 S S
S S
 H-О O Na -O O.
H-О O Na -O O.
Основную соль (FeOHCO3) можно представить как продукт частичного замещения гидроксогрупп в основании Fe(OH)3 на кислотный остаток угольной кислоты:
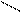
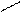
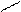 О ¾ H H-O O-H
О ¾ H H-O O-H
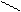
 Fe ¾ O ¾ H; C = O; Fe ¾ O
Fe ¾ O ¾ H; C = O; Fe ¾ O
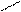
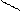
 O ¾ H H-O C = O.
O ¾ H H-O C = O.
O
|
|
