
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Квантовые числа
|
|
Четыре квантовых числа описывают состояние электрона в атоме и характеризуют энергию электрона, форму электронного облака, его ориентацию в пространстве и его спин. При переходе атома из одного состояния в другое происходит перестройка электронного облака, то есть изменяются значения квантовых чисел, что сопровождается поглощением или испусканием атомом квантов энергии.
Главное квантовое число (n) - характеризует энергию электрона на данном энергетическом уровне, используется как номер уровня, определяет размеры атомной орбитали. Главное квантовое число может принимать значения от 1 до ¥ (n = 1, 2, 3, 4... ¥). Иногда уровни обозначают буквами: 1 2 3 4...®...K L M N.., соответственно. Чем меньше n, тем больше энергия взаимодействия электрона с ядром. При n = 1 атом водорода находится в основном состоянии, при n > 1 – в возбужденном 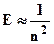 .
.
Орбитальное квантовое число (l) - определяет форму атомной орбитали (АО) и принимает значения от 0 до (n-1), то есть n значений. Каждому значению l соответствует орбиталь определенной формы (табл. 2.1, рис. 2.1.). Орбитальное квантовое число принято обозначать буквенными символами:
| s | p | d | f | g |
Электроны с одинаковым значением l образуют подуровень.
Таблица 2.1
Обозначение орбитального квантового числа и подуровней
| n (уровень) | l (подуровень) | Обозначение подуровней |
| 1s | ||
| 0, 1 | 2s, 2p | |
| 0, 1, 2 | 3s, 3p, 3d | |
| 0, 1, 2, 3 | 4s, 4p, 4d, 4f |
Решение уравнения Шредингера показало, что s-орбиталь (l = 0) имеет форму шара, p-орбиталь (l =1) - форму гантели и т. д. (рис. 2.1).
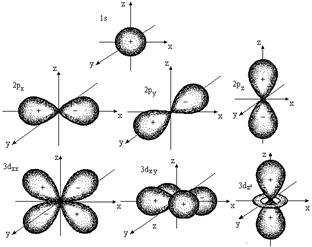
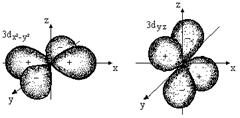
Рис. 2.1. Формы атомных орбиталей
Таким образом, для электронов первого энергетического уровня
(n = 1) возможна только одна форма орбитали (s) (рис. 2.1), для второго (n = 2) - две (s и p) и т. д. То есть энергетические уровни состоят из одного или нескольких энергетических подуровней. Для n = 1 возможен только один подуровень с l = 0, для n = 2 - два с l = 0 и l =1 и т д.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Состояние электрона в атоме обозначают цифрами и буквами. Например, электрон, у которого n = 1 и l = 0, обозначают 1s. 4p- состояние означает, что электрон находится на четвертом энергетическом уровне (n = 4); форма орбитали соответствует гантели (l = 1) и т.д.
Магнитное квантовое число (m) - характеризует пространственную ориентацию орбитали и принимает следующие значения:
0, ±1, ±2,... ± l.
Для каждого значения l разрешено (2 l + 1) значений m. Все орбитали одного подуровня l обладают одинаковой энергией, но по-разному ориентированы относительно друг друга.
Такие состояния называются вырожденными. Таким образом,
р- состояние трехкратно вырождено, d - пятикратно и т.д. (табл. 2.2).
Изучение атомных спектров показало, что трех квантовых чисел недостаточно для описания свойств электронов.

 Дополнительное четвертое квантовое число - спиновое (s) (" spin" - вращение, веретено) - характеризует собственный механический момент движе-
Дополнительное четвертое квантовое число - спиновое (s) (" spin" - вращение, веретено) - характеризует собственный механический момент движе-
Таблица 2.2
Подуровни и атомные орбитали
| l (подуровень) | m (орбиталь) | Число АО с данным значением l | Условное обозначение орбиталей |
 0 (s) 0 (s)
| (s) | ||
   1 (p) 1 (p)
| +1 0 -1 | (p) | |
     2 (d) 2 (d)
| +2 +1 0 -1 -2 | (d) | |
      3 (f) 3 (f)
| 3 2 1 0 -1 -2 -3 |  (f) (f)
|
ния электрона, которое условно представляют как вращение вокруг собственной оси. Оно может происходить в двух взаимно противоположных направлениях. Поэтому спиновое квантовое число имеет только два значения: +1/2 и - 1/2. Наличие спина у электрона было подтверждено экспериментально. Электроны с разными спинами обозначаются стрелками, направленными вверх  и вниз
и вниз 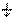 .
.
|
|
