
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
В многоэлектронном атоме
|
|
 В многоэлектронных атомах характеристики атомных орбиталей мало изменяются, однако состояния с разными l в таком атоме отличаются по энергии: чем больше l, тем больше энергия. Распределение электронов в атоме по энергетическим уровням и подуровням подчиняется следующим законам:
В многоэлектронных атомах характеристики атомных орбиталей мало изменяются, однако состояния с разными l в таком атоме отличаются по энергии: чем больше l, тем больше энергия. Распределение электронов в атоме по энергетическим уровням и подуровням подчиняется следующим законам:
1. Принцип наименьшей энергии. Электроны в атоме распределяются по орбиталям таким образом, что энергия атома оказывается наименьшей.
Каждой АО отвечает определенная энергия. Если энергия АО одинакова, то такие орбитали называют вырожденными. Расстояние между АО в единицах энергии называют расщеплением АО (DЕ). Для вырожденных АО DЕ = 0.
В случае одноэлектронного атома (Н, Не+, Li2+, Be3+ и т.д.) энергия АО зависит только от главного квантового числа - чем оно больше, тем больше энергия электрона на АО. Совокупность АО с одним и тем же n называется энергетическим уровнем. АО с одинаковыми n, l называют подуровнями.
2. Порядок следования АО по энергии определяется правилами Клечковского:
1) энергия электрона в основном определяется значениями главного (n) и орбитального (l) квантовых чисел, поэтому сначала электронами заполняются те подуровни, для которых сумма (n + l) меньше.
Например, можно было бы предположить, что 3d-подуровень по энергии ниже, чем 4s. Однако согласно правилу Клечковского, энергия 4s-состояния меньше, чем 3d, так как для 4s сумма (n + l) = 4 + 0 = 4, а для 3d - (n + l) = 3 + 2 = 5 (рис. 2.2).
2) В случае, если сумма (n+ l) для двух подуровней одинакова (например, для 3d- и 4p-подуровней эта сумма равна 5), сначала заполняется уровень с меньшим n.
Поэтому формирование энергетических уровней атомов элементов четвертого периода происходит в такой последовательности: 4s - 3d - 4p.
Например, 21Sc 1s22s22p63s23p64s23d1,
Таким образом, с учетом правил Клечковского энергия атомных орбиталей возрастает согласно ряду
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
| 1s < 2s < 2p < 3s < 3p < 4s» 3d < 4p < 5s» 4d < 5p < 6s» 4f»» 5d < 6p < 7s» 5f» 6d < 7p. |
Так как подуровни (n-1)d и ns близки, то при изменении числа электронов они могут меняться местами в энергетической шкале. Для простоты принято записывать электронные формулы в порядке увеличения значения квантовых чисел. Например, электронная формула галлия:
31Ga 1s22s22p63s23p63d104s24p1.
Пользуясь этим рядом, можно определить электронное строение любого атома. Для этого нужно последовательно добавлять и размещать на подуровнях и атомных орбиталях электроны. При этом нужно пользоваться еще рядом правил.
3. Емкость АО определяется принципом Паули: в атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел.
Иными словами, на одной АО, характеризуемой тремя квантовыми числами, может разместиться только два электрона с противоположными спинами, то есть для одной АО можно записать два возможных варианта заполнения:

 одним электроном ↑ и двумя электронами ↓ ↑.
одним электроном ↑ и двумя электронами ↓ ↑.
При этом конкретное направление спина для одного электрона на орбитали не имеет значения, важно лишь, что спины для двух электронов на одной АО имеют противоположные знаки. Принцип Паули и взаимозависимость между значениями n, l, и m определяют максимально возможное количество электронов на орбитали, подуровне и уровне (табл. 2.3):
- на одной АО - 2 электрона;
- на подуровне l - 2(2l+1) электрона;
- на уровне n - 2n2 электронов.
4. При заполнении электронами АО одного подуровня соблюдается порядок, определяемый правилами Гунда:
а) в данном подуровне электроны стремятся заполнять энергетические состояния таким образом, чтобы сумма их спинов по абсолютной величине была максимальна " (первое правило). (При этом энергия системы минимальна).
Таблица 2.3
Распределение электронов по энергетическим
уровням и подуровням
| Энергетич. уровень | Главное кв. число | Энергетич. подуровень | Атомные орбитали | Максимальное число ē | |
| подуровень | уровень | ||||
 1 1
| s (l =0) | ||||
| s (l =0) | |||||
   2 2
| p (l =1) | ||||

| s (l =0) | ||||
   3 3
| p (l =1) | ||||
    
| d (l =2) |
Например, рассмотрим электронную конфигурацию атома углерода. Порядковый номер атома равен 6. Это означает, что в атоме 6 электронов и они расположены на 2-х квантовых уровнях (атом углерода находится во втором периоде), т.е. 1s22s22p2. Графически 2р-подуровень можно изобразить тремя способами:

m 0 0 +1 0 -1 0 0 +1 0 -1 0 0 +1 0 -1
А б в
Сумма спинов в варианте а равна нулю. В вариантах б и в сумма спинов равна: ½ +½ = 1 (два спаренных электрона в сумме всегда дают ноль, поэтому учитываем неспаренные электроны).
б) При выборе между вариантами б и в руководствуемся вторым правилом Гунда: минимальной энергией обладает состояние с максимальной (по абсолютной величине) суммой магнитных квантовых чисел.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
В соответствии с правилом Гунда, таким образом, преимуществом обладает вариант б (|1+ 0| = 1), так как в варианте в |+1–1| = 0.
Определим, например, электронную формулу элемента ванадия (V). Так как его порядковый номер Z = 23, то нужно разместить на подуровнях и уровнях (их четыре, так как ванадий находится в четвертом периоде) 23 электрона. Последовательно заполняем: 1s22s22p63s23p6 3d34s2 (подчеркнуты незаконченные уровни и подуровни). Размещение электронов на 3d –АО по правилу Гунда будет:
m +2 +1 0 -1 -2
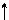
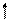
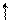





3d
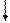
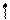
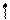
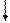
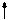


 Для селена (Z=34)полная электронная формула Se: 1s22s22p63s23p63d10 4s24p4.
Для селена (Z=34)полная электронная формула Se: 1s22s22p63s23p63d10 4s24p4.
Заполнение этого подуровня по правилу Гунда: 4p
Особую роль в химии играют электроны последних незаполненных уровней и подуровней, которые называются валентными (в формулах V, Se – подчеркнуты). Так, например, у V это электроны незаполненного четвертого уровня 4s2 и незаполненного подуровня 3d3; то есть валентными электронами будут: у V - 3d34s2 (5 э лектронов); для Se - 4s24p4 (6 электронов); 3d10-подуровень в этом случае заполнен и не является валентным (после заполнения он перемещается по энергии ниже, чем 4s, так что правильная последовательность заполненных подуровней у Se - 1s22s22p63s23p63d10 4s24p4).
По названию последнего заполняемого подуровня элементы называют:
s - элементы (Li:.. 2s1, Ca:... 4s2);
p - элементы (B...2s2 2p1, Se...4s2 4p4);
d – элементы (Sc.. 3d1 4s2, V.. 3d3 4s2);
f – элементы (La 4f1 6s2, Eu.. 4f7 6s2, U.. 5f47 s2).
(в формулах элементов подчеркнут последний заполняемый подуровень).
Найденные по описанной выше процедуре формулы валентных электронов называются каноническими (найденными по правилам). В действительности реальные формулы, определяемые из эксперимента или квантовомеханическим расчетом, несколько отличаются от канонических, то есть правила Гунда иногда нарушаются. Причины этих процессов рассмотрены ниже.
Пример 1. Записать электронную формулу атома элемента с атомным номером 16. Валентные электроны изобразить графически и один из них охарактеризовать квантовыми числами.
Решение. Атомный номер 16 имеет атом серы. Следовательно, заряд ядра равен 16, в целом атом серы содержит 16 электронов. Электронная формула атома серы записывается: 1s22s22p6 3s23p4. (Подчеркнуты валентные электроны).
Графическая формула валентных электронов: 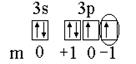
Состояние каждого электрона в атоме характеризуется четырьмя квантовыми числами. Электронная формула дает значения главного квантового числа и орбитального квантового числа. Так, для отмеченного электрона состояние 3p означает, что n = 3 и l = 1(р). Графическая формула дает значение еще двух квантовых чисел - магнитного и спинового. Для отмеченного электрона m = -1 и s = 1/2.
Пример 2. Охарактеризовать валентные электроны атома скандия четырьмя квантовыми числами.
Решение. Скандий находится в 4-м периоде, т.е. последний квантовый слой - четвертый, в 3-й группе, т.е. три валентных электрона.
Электронная формула валентных электронов: 3d14s2.
Графическая формула: 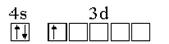
 m 0 +2 +1 0 -1 -2
m 0 +2 +1 0 -1 -2
№ электрона 1 2 3
|
|
