
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Примеры решения задач. Пример 6.1. При некоторой температуре в системе N2 (г) + 3Н2 (г) 2NH3 (г) равновесные концентрации составляли (моль/л): [N2] = 1,5; [H2] = 1,7; [NH3] = 2,6
|
|
Пример 6.1. При некоторой температуре в системе N2 (г) + 3Н2 (г) 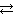 2NH3 (г) равновесные концентрации составляли (моль/л): [N2] = 1, 5; [H2] = 1, 7; [NH3] = 2, 6. Вычислить константу равновесия этой реакции и исходные концентрации азота и водорода.
2NH3 (г) равновесные концентрации составляли (моль/л): [N2] = 1, 5; [H2] = 1, 7; [NH3] = 2, 6. Вычислить константу равновесия этой реакции и исходные концентрации азота и водорода.
Решение. Константа равновесия данной реакции выражается уравнением
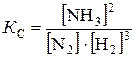 .
.
Подставляя данные задачи, получаем 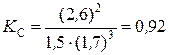 .
.
Исходные концентрации азота и водорода находим на основе уравнения реакции. Согласно уравнению реакции на образование 2 моль NH3 расходуется 1 моль N2. По условию задачи образовалось 2, 6 моль NH3, на что израсходовалось 1, 3 моль N2. Учитывая равновесную концентрацию азота, находим его исходную концентрацию: 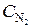 = 1, 5 + 1, 3 = 2, 8 моль/л.
= 1, 5 + 1, 3 = 2, 8 моль/л.
По уравнению реакции на образование 2 моль NH3 необходимо 3 моль H2, а для получения 2, 6 моль NH3 требуется 3× 2, 6/2 = 3, 9 моль H2. Исходная концентрация водорода 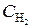 = 1, 7 + 3, 9 = 5, 6 моль/л. Таким образом, К С = 0, 92; исходные концентрации
= 1, 7 + 3, 9 = 5, 6 моль/л. Таким образом, К С = 0, 92; исходные концентрации 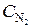 = 2, 8,
= 2, 8, 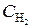 = 5, 6 моль/л.
= 5, 6 моль/л.
Пример 6.2. Реакция протекает по уравнению А + В 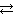 D + F. Определить равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В, соответственно, равны 2 и 1, 2 моль/л, а константа равновесия реакции К С = 1.
D + F. Определить равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В, соответственно, равны 2 и 1, 2 моль/л, а константа равновесия реакции К С = 1.
Решение. Так как все вещества в данной реакции реагируют в одинаковых соотношениях, обозначим изменение концентрации всех реагирующих веществ через x. К моменту установления равновесия образовалось х моль D и х моль F и соответственно [D] = x; [F] = x. По уравнению реакции на столько же уменьшились концентрации А и В, т. е. [A] = 2 – x; [B] = 1, 2 – x. Подставим равновесные концентрации в выражение константы равновесия:
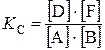 ;
; 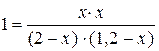 ; х = 0, 75.
; х = 0, 75.
Отсюда равновесные концентрации равны: [D] = 0, 75 моль/л; [F] = 0, 75 моль/л;
[A] = 2 – 0, 75 = 1, 25 моль/л; [B] = 1, 2 – 0, 75 = 0, 45 моль/л.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Пример 6.3. Реакция протекает по уравнению 2SO2 + O2 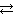 2SO3. В каком направлении сместится химическое равновесие, если объем системы уменьшить в 3 раза?
2SO3. В каком направлении сместится химическое равновесие, если объем системы уменьшить в 3 раза?
Решение. До изменения объема скорости прямой и обратной реакций выражались уравнениями:
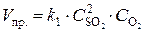 ;
; 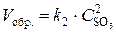 .
.
При уменьшении объема в 3 раза концентрация каждого из реагирующих веществ увеличится в 3 раза. После увеличения концентрации скорость прямой реакции стала 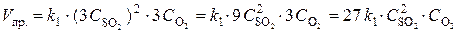 ,
,
т. е. возросла в 27 раз; а скорость обратной – 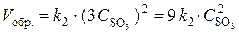 , т. е. возросла в 9 раз. Следовательно, равновесие сместится в сторону прямой реакции (вправо).
, т. е. возросла в 9 раз. Следовательно, равновесие сместится в сторону прямой реакции (вправо).
Пример 6.4. В какую сторону сместится химическое равновесие реакции А + В 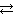 D, если повысить температуру на 30 °С? Температурные коэффициенты скорости прямой (γ 1) и обратной (γ 2) реакции равны соответственно 2 и 3.
D, если повысить температуру на 30 °С? Температурные коэффициенты скорости прямой (γ 1) и обратной (γ 2) реакции равны соответственно 2 и 3.
Решение. При повышении температуры на 30° скорость прямой реакции возрастет в 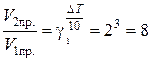 раз, а скорость обратной в
раз, а скорость обратной в 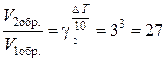 раз. Так как скорость обратной реакции возросла в 27 раз, а скорость прямой в 8 раз, то равновесие этой реакции при повышении температуры сместится в сторону обратной реакции (влево).
раз. Так как скорость обратной реакции возросла в 27 раз, а скорость прямой в 8 раз, то равновесие этой реакции при повышении температуры сместится в сторону обратной реакции (влево).
Пример 6.5. Как изменятся скорости прямой и обратной реакции, если в системе 2NO (г) + О2 (г) 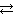 2NO2 (г) уменьшить давление в 2 раза? Произойдет ли при этом смещение равновесия? Если да, то в какую сторону?
2NO2 (г) уменьшить давление в 2 раза? Произойдет ли при этом смещение равновесия? Если да, то в какую сторону?
Решение. До уменьшения давления выражения для скорости прямой и обратной реакции имели вид 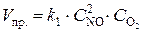 ;
; 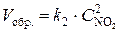 .
.
При уменьшении давления в 2 раза концентрации каждого из реагирующих веществ уменьшаются в 2 раза, так как общий объем системы увеличивается в 2 раза. Тогда  ;
;
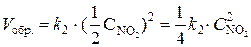 .
.
В результате уменьшения давления скорость прямой реакции уменьшилась в 8 раз, а скорость обратной – в 4 раза. Таким образом, скорость обратной реакции будет в 2 раза больше, чем прямой, и смещение равновесия произойдет в сторону обратной реакции, т. е. в сторону разложения NO2.
Пример 6.6. В каком направлении сместится равновесие реакции
COCl2 ↔ СО + Cl2, ∆ H° х.р. = +112, 5 кДж
а) при повышении давления; б) с понижением температуры; в) при уменьшении концентрации хлора?
Решение. а). При повышении давления равновесие смещается в сторону реакции, идущей с уменьшением числа молекул газа, при понижении давления – в сторону реакции, идущей с увеличением числа молекул газа. В левой части приведенной реакции 1 молекула (COCl2), а в правой – 2 (1 СО и 1 Cl2), поэтому при повышении давления равновесие смещается в сторону обратной реакции.
б). При понижении температуры равновесие смещается в сторону экзотермической реакции, при повышении температуры – в сторону эндотермической. В нашем примере прямая реакция эндотермическая (∆ H° х.р. > 0), а обратная – экзотермическая, следовательно, при понижении температуры равновесие сместится в сторону обратной реакции. в). При увеличении концентрации исходных веществ и уменьшении концентрации продуктов реакции равновесие смещается в сторону продуктов реакции. При уменьшении концентрации хлора (продукта реакции) равновесие сместится в сторону прямой реакции, т.е. в сторону образования продуктов реакции.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
|
|
