
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Примеры решения задач. Пример 4.1. Как изменится скорость реакции каждой из реакций:
|
|
Пример 4.1. Как изменится скорость реакции каждой из реакций:
2NO (г) + Cl2 (г) = 2NOCl (г); (1);
СаО (к) + СО2 (г) = СаСО3 (к), (2),
если в каждой системе увеличить давление в 3 раза?
Решение. Реакция (1) гомогенная и, согласно закону действия масс, начальная скорость реакции равна 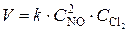 ; реакция (2) гетерогенная, и ее скорость выражается уравнением
; реакция (2) гетерогенная, и ее скорость выражается уравнением 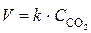 . Концентрация веществ, находящихся в твердой фазе (в данной реакции СаО), не изменяется в ходе реакции, поэтому не включается в уравнение закона действия масс.
. Концентрация веществ, находящихся в твердой фазе (в данной реакции СаО), не изменяется в ходе реакции, поэтому не включается в уравнение закона действия масс.
Увеличение давления в каждой из систем в 3 раза приведет к уменьшению объма системы в 3 раза и увеличению концентрации каждого из реагирующих газообразных веществ в 3 раза. При новых концетрациях скорости реакций рассчитываются по формулам:
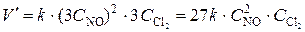 (1) и
(1) и 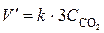 (2).
(2).
Сравнивая выражения для скоростей V и V', находим, что скорость реакции (1) возрастает в 27 раз, а реакции (2) – в 3 раза.
Пример 4.2. Реакция между веществами А и В выражается уравнением
2А + В = D. Начальные концентрации составляют (моль/л): СА = 5, СВ = 3, 5. Константа скорости равна 0, 4. Вычислить скорость реакции в начальный момент и в тот момент, когда в реакционной смеси останется 60 % вещества А.
Решение. По закону действия масс 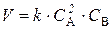 . В начальный момент скорость V 1= 0, 4× 52× 3, 5 = 35. По истечении некоторого времени в реакционной смеси останется 60 % вещества А, т. е. концентрация вещества А станет равной 5× 0, 6 = 3 моль/л. Значит, концентрация А уменьшилась на 5− 3 = 2 моль/л. Так как А и В взаимодействуют между собой в соотношении 2: 1, то концентрация вещества В уменьшилась на 1 моль и стала равной 3, 5 – 1 = 2, 5 моль/л.
. В начальный момент скорость V 1= 0, 4× 52× 3, 5 = 35. По истечении некоторого времени в реакционной смеси останется 60 % вещества А, т. е. концентрация вещества А станет равной 5× 0, 6 = 3 моль/л. Значит, концентрация А уменьшилась на 5− 3 = 2 моль/л. Так как А и В взаимодействуют между собой в соотношении 2: 1, то концентрация вещества В уменьшилась на 1 моль и стала равной 3, 5 – 1 = 2, 5 моль/л.
Следовательно, V 2 = 0, 4× 32× 2, 5 = 9.
Пример 4.3. Через некоторое время после начала реакции 2NO + O2 = 2NO2 концентрации веществ составляли (моль/л): 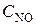 = 0, 06;
= 0, 06; 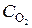 = 0, 12;
= 0, 12; 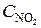 = 0, 216. Найти исходные концентрации NO и O2.
= 0, 216. Найти исходные концентрации NO и O2.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Решение. Исходные концентрации NO и O2 находим на основе уравнения реакции, согласно которому на образование 2 моль NO2 расходуется 2 моль NO. По условию задачи образовалось 0, 216 моль NO2, на что израсходовалось 0, 216 моль NO. Значит, исходная концентрация NO равна
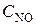 = 0, 06 + 0, 216 = 0, 276 моль/л.
= 0, 06 + 0, 216 = 0, 276 моль/л.
По уравнению реакции на образование 2 моль NO2 необходимо 1 моль О2, а для получения 0, 216 моль NO2 требуется 0, 216/2 = 0, 108 моль О2. Исходная концентрация О2 равна 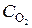 = 0, 12 + 0, 108 = 0, 228 моль/л.
= 0, 12 + 0, 108 = 0, 228 моль/л.
Таким образом, исходные концентрации составляли:
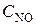 = 0, 276 моль/л;
= 0, 276 моль/л; 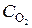 = 0, 228 моль/л.
= 0, 228 моль/л.
Пример 4.4. При 323 К некоторая реакция заканчивается за 30 с. Определить, как изменится скорость реакции и время ее протекания при 283 К, если температурный коэффициент скорости реакции равен 2.
Решение. По правилу Вант-Гоффа находим, во сколько раз изменится скорость реакции:  .
.
Скорость реакции уменьшается в 16 раз. Скорость реакции и время ее протекания связаны обратно пропорциональной зависимостью. Следовательно, время протекания данной реакции увеличится в 16 раз и составит 30× 16 = 480 с = 8 мин.
|
|
