
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Примеры решения задач. Пример 7.1. Водный раствор содержит 354 г H3PO4 в 1 л
|
|
Пример 7.1. Водный раствор содержит 354 г H3PO4 в 1 л. Плотность раствора ρ = 1, 18 г/мл. Вычислить: а) массовую долю (%) H3PO4 в растворе; б) молярную концентрацию; в) молярную концентрацию эквивалентов; г) моляльность;
д) титр; е) молярные доли H3PO4 и Н2О.
Решение. а). Для расчета массовой доли воспользуемся формулой
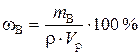 ;
; 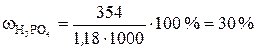 .
.
б). Молярная концентрация вещества В или молярность(с В или М) – отношение количества растворенного вещества к объему раствора:
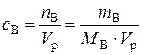 , моль/л, (1)
, моль/л, (1)
где n B – количество вещества В, моль; m B – масса вещества В, г; М В– молярная масса вещества В, г/моль; V р– объем раствора, л.
Молярная масса H3PO4 равна 98 г/моль. Молярную концентрацию раствора находим из соотношения (1):
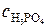 =
= 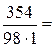 3, 61 моль/л.
3, 61 моль/л.
в). Молярную концентрацию эквивалентов рассчитываем по формуле 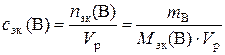 . Молярная масса эквивалентов H3PO4 равна
. Молярная масса эквивалентов H3PO4 равна 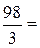 32, 7 г/моль.
32, 7 г/моль. 
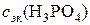 =
= 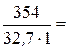 10, 83 моль/л.
10, 83 моль/л.
г). Моляльная концентрация вещества В или моляльность(с m(B)) – отношение количества растворенного вещества к массе растворителя:
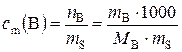 , моль/кг, (2)
, моль/кг, (2)
где n В – количество вещества В, моль; m B – масса вещества В, г; m S – масса растворителя, г; М В − молярная масса вещества В, г/моль.
Для определения моляльности по формуле (2) необходимо рассчитать массу растворителя в растворе. Масса раствора составляет 1, 18∙ 1000 = 1180 г.
Масса растворителя в растворе m S = 1180 – 354 = 826 г.
Моляльная концентрация раствора равна
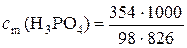 = 4, 37 моль/кг.
= 4, 37 моль/кг.
д). Титр раствора можно рассчитать по формулам:
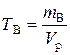 ;
; 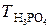 =
= 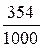 = 0, 354 г/мл,
= 0, 354 г/мл,
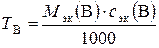 ;
; 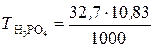 = 0, 354 г/мл,
= 0, 354 г/мл,
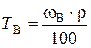 ;
; 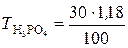 = 0, 354 г/мл.
= 0, 354 г/мл.
е). Молярная (мольная) доля вещества В(х В), безразмерная величина – отношение количества данного вещества к суммарному количеству всех веществ, составляющих раствор, включая растворитель.
Если раствор состоит из одного растворенного вещества и растворителя, то молярная доля вещества (х В) равна
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
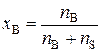 , (3)
, (3)
а молярная доля растворителя (x S)
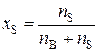 , (4)
, (4)
где n B – количество растворенного вещества, моль; n S – количество вещества растворителя, моль.
Сумма молярных долей всех веществ раствора равна единице.
В 1 л раствора содержится 3, 61 моль H3PO4 (см. пункт б). Масса растворителя в растворе 826 г, что составляет 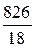 = 45, 9 моль.
= 45, 9 моль.
Молярные доли H3PO4 и Н2О рассчитываем по формулам (3) и (4):
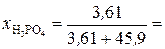 0, 073;
0, 073;
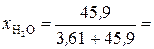 0, 927.
0, 927.
Пример 7. 2. Сколько миллилитров 50 %-го раствора HNO3, плотность которого 1, 32 г/мл, требуется для приготовления 5 л 2 %-го раствора, плотность которого 1, 01 г/мл?
Решение. При решении задачи пользуемся формулой
 .
.
Сначала находим массу азотной кислоты в 5 л 2 %-го раствора:
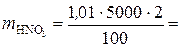 101 г.
101 г.
Чтобы ответить на вопрос задачи, надо определить, в каком объеме раствора с массовой долей HNO3 50 % содержится 101 г HNO3:
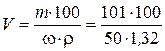 = 153 мл.
= 153 мл.
Таким образом, для приготовления 5 л 2 %-го раствора HNO3 требуется 153 мл 50 %-ного раствора HNO3.
Пример 7. 3. На нейтрализацию 50 мл раствора  кислоты израсходовано 25 мл 0, 5 н. раствора щелочи. Чему равна нормальность кислоты?
кислоты израсходовано 25 мл 0, 5 н. раствора щелочи. Чему равна нормальность кислоты?
Решение. Так как вещества взаимодействуют между собой в эквивалентных количествах, то можно написать
V A ∙ н. (А) = V B ∙ н. (B);
50∙ н. (кислоты ) = 25∙ 0, 5, отсюда
н. (кислоты) = 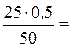 0, 25 н..
0, 25 н..
Следовательно, для реакции был использован 0, 25 н. раствор кислоты.
|
|
