
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Задачи и упражнения для самостоятельного решения. 4.1. Реакция протекает по уравнению 3Н2 + СО = СН4 + H2O.
|
|
4.1. Реакция протекает по уравнению 3Н2 + СО = СН4 + H2O.
Начальные концентрации реагирующих веществ были (моль/л): 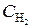 = 0, 8; C CO = 0, 6. Как изменится скорость реакции, если концентрацию водорода увеличить до 1, 2, а концентрацию оксида углерода до 0, 9 моль/л?
= 0, 8; C CO = 0, 6. Как изменится скорость реакции, если концентрацию водорода увеличить до 1, 2, а концентрацию оксида углерода до 0, 9 моль/л?
(Ответ: увеличится в 5 раз).
4.2. Реакция разложения N2O идет по уравнению 2N2O = 2N2 + O2. Константа скорости реакции равна 5· 10–4. Начальная концентрация 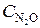 = 0, 32 моль/л.
= 0, 32 моль/л.
Определить скорость реакции в начальный момент и в тот момент, когда разложится 50 % N2O. (Ответ: 5, 12 . 10-5; 1, 28 . 10-5).
4.3. Реакция между веществами А и В выражается уравнением А + 2В = D. Начальные концентрации (моль/л): С А = 0, 3 и С В = 0, 4. Константа скорости равна 0, 8. Вычислить начальную скорость реакции и определить, как изменилась скорость реакции по истечении некоторого времени, когда концентрация вещества А уменьшилась на 0, 1 моль. (Ответ: 3, 84 . 10-2; уменьшилась в 6 раз).
4.4. Чему равен температурный коэффициент скорости реакции, если при понижении температуры на 30 °С, время протекания реакции увеличилось в 64 раза? (Ответ: 4).
№ 4.5. Вычислить, при какой температуре реакция закончится за 45 мин, если при 20 °С на это потребуется 3 ч. Температурный коэффициент скорости реакции равен 3. (Ответ: 33 °С).
4.6. Как изменится скорость реакции CO + Cl2 = COCl2, если повысить давление в 3 раза и одновременно повысить температуру на 30 °С (γ = 2)?
(Ответ: увеличится в 72 раза).
4.7. Реакции протекают по уравнениям:
С (к) + О2 (г) = СО2 (г); (1)
2СО (г) + О2 (г) = 2СО2 (г). (2)
Как изменится скорость (1) и (2) реакций, если в каждой системе: а) уменьшить давление в 3 раза; б) увеличить объем сосуда в 3 раза; в) повысить концентрацию кислорода в 3 раза? (Ответ: а) уменьшится в (1) в 3, во (2) в 27 раз;
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
б) уменьшится в (1) в 3, во (2) в 27 раз; в) увеличится в (1) и (2) в 3 раза).
4.8. Реакция идет по уравнению H2 + I2 = 2HI. Константа скорости равна 0, 16. Исходные концентрации Н2 и I2 соответственно равны 0, 04 и 0, 05 моль/л. Вычислить начальную скорость реакции и ее скорость, когда концентрация Н2 станет равной 0, 03 моль/л. (Ответ: 3, 2 . 10-4; 1, 9 . 10-4).
4.9. Окисление серы и ее диоксида протекает по уравнениям:
S (к) + О2 (г) = SO2 (г); (1)
2SO2 (г) + О2 (г) = 2SO3 (г). (2)
Как изменится скорость (1) и (2) реакций, если в каждой системе: а) увеличить давление в 4 раза; б) уменьшить объем сосуда в 4 раза; в) повысить концентрацию кислорода в 4 раза? (Ответ: а) увеличится в (1) в 4, во (2) − в 64 раза; б) увеличится в (1) в 4, во (2) − в 64 раза; в) увеличится в (1) и (2) в 4 раза.
4.10. Константа скорости реакции 2А + В = D равна 0, 8. Начальные концентрации (моль/л): С А = 2, 5 и С В = 1, 5. В результате реакции концентрация вещества С В оказалась равной 0, 6 моль/л. Вычислить, чему стала равна С А и скорость реакции. (Ответ: 0, 7 моль/л; 0, 235).
4.11. Реакция протекает по уравнению
4HCl + O2 = 2H2O + 2Cl2.
Через некоторое время после начала реакции концентрации участвующих в ней веществ стали (моль/л): 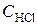 = 0, 85;
= 0, 85; 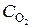 = 0, 44;
= 0, 44; 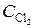 = 0, 30. Вычислить начальные концентрации HCl и О2. (Ответ:
= 0, 30. Вычислить начальные концентрации HCl и О2. (Ответ: 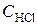 = 1, 45;
= 1, 45; 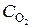 = 0, 59 моль/л).
= 0, 59 моль/л).
4.12. Начальные концентрации веществ в реакции СО + Н2О ↔ СО2 + Н2 были равны (моль/л): C CO = 0, 5; 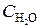 = 0, 6;
= 0, 6; 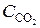 = 0, 4;
= 0, 4; 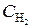 = 0, 2. Вычислить концентрации всех участвующих в реакции веществ после того, как прореагировало 60 % Н2О. (Ответ: C CO = 0, 14;
= 0, 2. Вычислить концентрации всех участвующих в реакции веществ после того, как прореагировало 60 % Н2О. (Ответ: C CO = 0, 14; 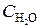 = 0, 24;
= 0, 24; 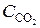 = 0, 76;
= 0, 76; 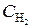 = 0, 56 моль/л).
= 0, 56 моль/л).
4.13. Как изменится скорость реакции 2СО + О2 = СО2, если: а) объем реакционного сосуда увеличить 3 раза; б) увеличить концентрацию СО в 3 раза; в) повысить температуру на 40 °С (γ = 2)? (Ответ: а) уменьшится в 27 раз; б) увеличится в 9 раз; в) увеличится в 16 раз).
4.14. При 10 °С реакция заканчивается за 20 мин. Сколько времени будет длиться реакция при повышении температуры до 40 °С, если температурный коэффициент равен 3? (Ответ: 44, 4 с).
4.15. Во сколько раз следует увеличить а) концентрацию СО в системе 2СО = СО2 + С, чтобы скорость реакции возросла в 4 раза? б) концентрацию водорода в системе N2 + 3H2 = 2NH3, чтобы скорость реакции возросла в 100 раз? в) давление в системе 2NO + O2 = 2NO2, чтобы скорость образования NO2 возросла в 103 раз? (Ответ: 2 раза; 4, 64 раза; 10 раз).
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
4.16. Скорость реакции А + 2В = АВ2 при С А = 0, 15 и С В = 0, 4 моль/л равна 2, 4∙ 10− 3. Определить константу скорости и скорость реакции, когда концентрация В станет 0, 2 моль/л. (Ответ: 0, 1; 2∙ 10-4).
4.17. Как изменится скорость реакции 2А + В = А2В, если концентрацию вещества А увеличить в 3 раза, концентрацию вещества В уменьшить в 2 раза, а температуру повысить на 40 °С (γ = 2)? (Ответ: увеличится в 72 раза).
4.18. Реакция идет по уравнению 2H2S + 3O2 = 2SO2 + 2H2O. Через некоторое время после начала реакции концентрации участвующих в ней веществ стали (моль/л): 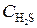 = 0, 009;
= 0, 009; 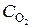 = 0, 02;
= 0, 02; 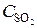 = 0, 003. Вычислить: а) концентрацию водяного пара в этот момент; б) исходные концентрации сероводорода и кислорода. (Ответ:
= 0, 003. Вычислить: а) концентрацию водяного пара в этот момент; б) исходные концентрации сероводорода и кислорода. (Ответ: 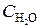 = 0, 003;
= 0, 003; 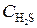 = 0, 012;
= 0, 012; 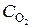 = 0, 0245 моль/л).
= 0, 0245 моль/л).
4.19. Две реакции протекают при 25 °С с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2, второй – 3. Найти отношение этих скоростей при 75 °С. (Ответ: V 2/ V 1 = 7, 59).
4.20. Реакция идет по уравнению N2 + 3H2 = 2NH3. Через некоторое время после начала реакции концентрации реагирующих веществ были (моль/л):
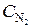 = 0, 8;
= 0, 8; 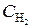 = 1, 5;
= 1, 5; 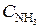 = 0, 1. Вычислить концентрации веществ в момент, когда концентрация N2 стала 0, 5 моль/л. (Ответ:
= 0, 1. Вычислить концентрации веществ в момент, когда концентрация N2 стала 0, 5 моль/л. (Ответ: 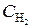 = 0, 6;
= 0, 6; 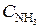 = 0, 7 моль/л).
= 0, 7 моль/л).
|
|
