
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Примеры решения задач. Пример 5.1.Промышленная установка, работающая на ванадиевом катализаторе (V2O5), производит в сутки 30000 кг моногидрата H2SO4
|
|
Пример 5.1. Промышленная установка, работающая на ванадиевом катализаторе (V2O5), производит в сутки 30000 кг моногидрата H2SO4. Объем катализатора в установке 0, 7 м3. Рассчитать активность катализатора.
Решение. Мерой активности катализатора является изменение скорости химической реакции в результате введения в систему катализатора. Количественно активность катализатора оценивается производительностью катализатора (A k). Под производительностью катализатора подразумевают количество вещества, получающееся в единицу времени с единицы площади поверхности (S k), массы (m k) или объема (V k) катализатора. Производительность катализатора равна
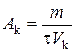 ,
,
где m − масса получаемого вещества; τ − время протекания процесса.
Для определения производительности катализатора выразим время в часах:
A k = 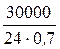 = 1785, 7 кг/(м3∙ час).
= 1785, 7 кг/(м3∙ час).
Таким образом, активность ванадиевого катализатора при получении моногидрата H2SO4 равна 1785, 7 кг/(м3∙ час).
Пример 5.2. Энергия активации некоторой реакции без катализатора равна 75, 24 кДж/моль, а с катализатором – 50, 14 кДж/моль. Во сколько раз возрастет скорость реакции в присутствии катализатора, если реакция протекает при 25 °С?
Решение. Обозначим энергию активации реакции без катализатора через E a, а с катализатором – через E a /, соответствующие константы скорости реакции обозначим через k и k/ . Для решения задачи используем преобразованное уравнение Аррениуса:  .
.
Подставляя в это уравнение данные задачи, выражая энергию активации в джоулях и учитывая, что Т = 298 К, получим
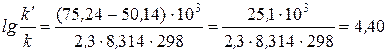 .
.
Окончательно находим k/ / k = 2, 5∙ 104. Таким образом, снижение энергии активации на 25, 1 кДж привело к увеличению скорости реакции в 25 тысяч раз.
|
|
