
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кинетика электрохимической коррозии
|
|
Термодинамика электрохимической коррозии металлов Термодинамическую возможность электрохимической коррозии, как любого химического процесса, можно определить по изменению энергии Гиббса. Поскольку коррозия является самопроизвольно протекающим процессом, то сопровождается ее убылью, т.е. ∆ GT< 0
Т.к. электрохимическая коррозия представляет собой работу совокупности микрогальванических элементов, то ее термодинамическую возможность можно оценить и по знаку электродвижущей силы (ЭДС). Последняя связана с энергией Гиббса соотношением:
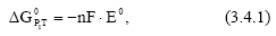
Отрицательному значению 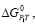 , как видно, соответствуют положительное значение ЭДС, которое рассчитывают по разности электродных потенциалов катода и анода или окислителя и восстановителя
, как видно, соответствуют положительное значение ЭДС, которое рассчитывают по разности электродных потенциалов катода и анода или окислителя и восстановителя
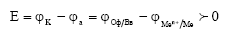
Из этого соотношения следует, что коррозия возможна при условии, что потенциал окислителя положительнее потенциала металла, т.е. 
являются реакциями кислородного и водородного электродов, потенциалы которых зависят от парциального давления газов и кислотности растворов.
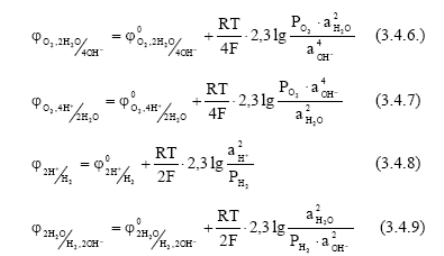
Если потенциал металла положительнее кислородного или водородного электродов, то коррозия металлов невозможна. Например, потенциал золота 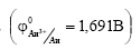 в отсутствии комплексообразователей положительнее потенциала кислородного электрода во всей области РН, поэтому оно не корродирует ни с поглощением кислорода, ни с выделением водорода.
в отсутствии комплексообразователей положительнее потенциала кислородного электрода во всей области РН, поэтому оно не корродирует ни с поглощением кислорода, ни с выделением водорода.
Если потенциал металла отрицательнее потенциала кислородного электрода, но положительнее потенциала водородного электрода, то коррозия возможна с поглощением кислорода и невозможна с выделением водорода (Cd, Ni, Sn, Cu).
Наконец, если потенциал металла отрицательнее потенциала водородного электрода, то возможна его коррозия как с поглощением кислорода, так и с выделением водорода (Al, Zn, щелочные и щелочноземельные металлы). У них коррозия с водородной деполяризацией термодинамически менее вероятна. Однако реализация термодинамической возможности кинетическими факторами, которые влияют на поляризуемость электрода, т.е. на перенапряжение электродных реакций.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Величины стандартных электродных потенциалов 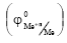 металлов позволяют приближенно судить об их термодинамической стабильности: чем отрицательнее значение потенциала металла, тем выше его восстановительная способность – способность отдавать электроны.
металлов позволяют приближенно судить об их термодинамической стабильности: чем отрицательнее значение потенциала металла, тем выше его восстановительная способность – способность отдавать электроны.
По величине стандартного электродного потенциала все металлы разделяют на пять групп, каждая из которых отделена друг от друга значениями потенциалов водородного и кислородного электродов в кислотной (РН< 7) и нейтральной (РН=7) средах: (При изменении РН раствора от 0 до 14 потенциал водородного электрода изменяется от 0 до – 0, 828В, потенциал кислородного электрода от 1, 229 до 0, 401В).
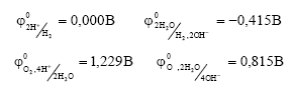
1) Металлы низкой термодинамической стабильности 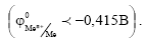
Это Na, Mg, Be, Al, Zn и др. Они могут корродировать даже в нейтральных средах, не содержащих кислород и окислители.
2) Металлы термодинамически нестабильные 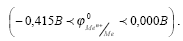
Это Cd, Ni, Mn, Sn, Pb и др. Они устойчивы в нейтральных средах, не содержащих кислород, в кислотных же средах корродируют даже в его отсутствии.
3) Металлы промежуточной термодинамической активности 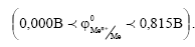 Это Ag, Cu, Bi, Re, Rh и др. Они устойчивы в кислотных и нейтральных средах в отсутствии кислорода и окислителей.
Это Ag, Cu, Bi, Re, Rh и др. Они устойчивы в кислотных и нейтральных средах в отсутствии кислорода и окислителей.
4) Металлы высокой термодинамической стабильности 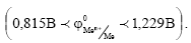 Это Pt, Pd, Ir и др. Они не корродируют в присутствии кислорода в нейтральных средах.
Это Pt, Pd, Ir и др. Они не корродируют в присутствии кислорода в нейтральных средах.
5) Металлы полной термодинамической стабильности 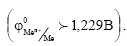 Они устойчивы в кислотных средах даже в писутствии кислорода, однако могут корродировать в растворах, комплексообразователей при наличии окислителей. К этой группе относится золото (Аu).
Они устойчивы в кислотных средах даже в писутствии кислорода, однако могут корродировать в растворах, комплексообразователей при наличии окислителей. К этой группе относится золото (Аu).
Эта классификация металлов коррелирует с их положением в периодической системе элементов Д.И.Менделеева: наиболее коррозионно-стойкие располагаются внизу группы переходных элементов (Os, Ir, Pt, Au). В левых подгруппах (IV B, VI B, VII B) находятся легко пассивирующие металлы, причем с ростом порядкового номера склонность к пассивации в подгруппе падает.
|
|
