
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Схемы и характерные особенности электрохимического коррозионного процесса.
|
|
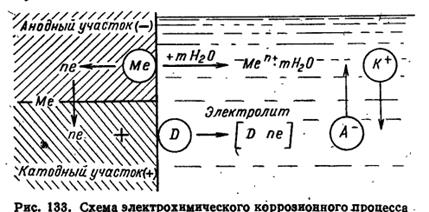
Электрохимическое растворение металла – сложный процесс, состоящий из трех основных процессов:
1) анодного процесса – образования гидратированных ионов металла в электролите и некомпенсированных электронов на анодных участках по реакции
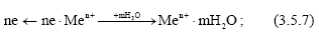
2) процесс протекания электронов по металлу от анодных участков к катодным и соответствующего перемещения катионов и анионов в растворе;
3) катодного процесса – ассимиляция электронов какими-либо ионами или молекулами раствора (деполяризаторами), способными к восстановлению на катодных участках по реакции
Д+ne=(-Дne)
Таким образом протекание электрохимического процесса на неоднородной (гетерогенной) поверхности металла аналогично работе короткозамкнутого гальванического элемента. При замыкании в электролите двух электродов с разными потенциалами происходит протекание электронов от более отрицательного электрода (анода) к менее отрицательному (или более положительному) электроду (катоду). Это протекание электронов выравнивает значения потенциалов замкнутых электродов. Если бы при этом электродные процессы (анодный на аноде и катодный на катоде) не протекали, потенциалы электродов сравнялись бы и наступила бы полная поляризация.
|
В действительности анодный и катодный электродные процессы не прекращаются, а продолжают протекать, препятствуя наступлению полной поляризации, т.е. действуют деполяризующе. Отсюда, в частности, происходит и название ионов или молекул раствора, обеспечивающих протекание катодного процесса – «деполяризаторы».
Характерными особенностями электрохимического коррозионного процесса являются:
1) подразделение его на два одновременно протекающих, но в значительной степени независимых электродных процесса: анодный и катодный;
2) зависимость кинетики этих двух электрохимических процессов, а, следовательно, и скорости коррозии в соответствии с законами электрохимической кинетики от величины электродного потенциала металла: смещение потенциала металла в положительную(например, в результате поляризации от внешнего источника тока) обычно облегчает анодный процесс и затрудняет катодный; смещение потенциала в отрицательную сторону, наоборот, ускоряет катодный процесс и тормозит анодный;
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
3) возможность локализации анодного и катодного процессов на различных участках поверхности корродирующего металла, где их протекание облегчено;
|
|
