
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Двойной электрический слой и электродные потенциалы металлов.
|
|
При погружении металлов в электролит в результате взаимодействия между ними возникает разность электрических потенциалов, что связано с образованием двойного электрического слоя, то есть несимметричного распределения заряженных частиц у границы раздела фаз. Причинами возникновения этого скачка потенциала между металлом и электролитом является:
1) переход заряженных частиц (катионов) из одной фазы в другую (рисунок 3.2.1, а и б) из металла в электролит или, наоборот, с образованием двойного электрического слоя в пределах этих двух фаз:

2) избирательная адсорбция на поверхности металла частиц из жидкой фазы – ионов (например Cl–) или полярных молекул (например Н2О) и появление противоположного заряда в ближайшем слое электролита с образованием двойного электрического слоя в пределах одной (жидкой) фазы рисунок 3.2.2. (в, г):
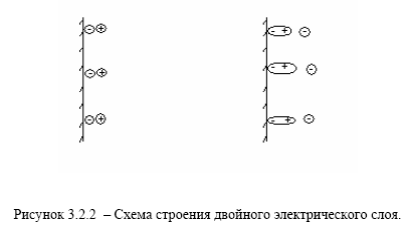
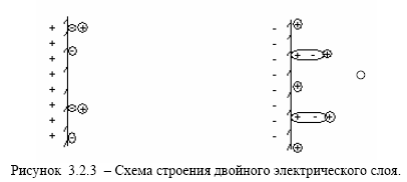
3) образование двойного слоя, обусловленного обеими причинами, т.е адсорбционно – ионного скачка потенциала (например, при адсорбции анионов, или при адсорбции поляризуемых молекул или атомов, например, кислорода) на поверхности металла в условиях наличия перехода катионов из металла в электролит или из электролита в металл рисунок 3.2.3 (д, е).-
Скачок потенциала между двумя фазами не может быть измерен, но можно измерить электродвижущую силу элемента, составленного из исследуемого раствора (например, Ме в электролите) и электрода, потенциал которого условно принят за нуль (стандартного водородного электрода). Эту ЭДС принято называть электродным потенциалом металла.
Если при взаимодействии металла с электролитом (водным раствором) фазовую границу пересекают только ионы металла, то протекают два процесса:
1) переход этих ионов из металла в раствор с образованием гидратированных ионов (окислительный или анодный процесс), скорость которого, измеряемая числом ионов, преходящих из фазы в фазу в единицу времени, может быть выражена через соответствующий ток 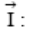
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
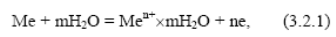
2) разряд этих ионов из раствора с выделением их на поверхности металла в виде нейтральных атомов, входящих в состав кристаллической решетки металла (восстановительный или катодный процесс), скорость которого также может быть выражена через соответствующий ток 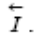
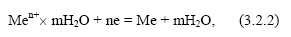
Какой из этих процессов преобладает, определяется уровнем потенциальной энергии катионов в узлах кристаллической решетки металла ПМе и в растворе Пр. Если ПМе > ПР, то 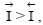 т.е. преобладает анодный процесс – переход ионов металла в раствор (рисунок 3.2.1, а), суммарная скорость которого равна
т.е. преобладает анодный процесс – переход ионов металла в раствор (рисунок 3.2.1, а), суммарная скорость которого равна 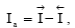 если ПР> ПМе, то
если ПР> ПМе, то 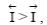 т.е. преобладает катодный процесс – разряд ионов металла из раствора (рисунок 3.2.1, б),
т.е. преобладает катодный процесс – разряд ионов металла из раствора (рисунок 3.2.1, б), 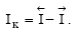 Образующийся двойной электрический слой затрудняет протекание прямого процесса и облегчает протекание обратного. Когда потенциал в нем достигает значения, при котором энергетический уровень ионов в металле и растворе становится одинаковым, т.е. ПМе = ПР (что наступает довольно быстро), устанавливается динамическое равновесие, при котором скорости анодного и катодного процессов равны
Образующийся двойной электрический слой затрудняет протекание прямого процесса и облегчает протекание обратного. Когда потенциал в нем достигает значения, при котором энергетический уровень ионов в металле и растворе становится одинаковым, т.е. ПМе = ПР (что наступает довольно быстро), устанавливается динамическое равновесие, при котором скорости анодного и катодного процессов равны 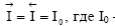 – ток обмена, обусловленный постоянно протекающим обменом ионами между металлами и раствором.
– ток обмена, обусловленный постоянно протекающим обменом ионами между металлами и раствором.
3. Обратимые и необратимые электродные потенциалы металлов.
При погружении металлов в электролиты возможно появление электродных потенциалов двух родов: обратимых и необратимых.
Обратимый электродный потенциал металла (φ Me)обр устанавливается, когда в процессе обмена, определяющего потенциал металла в электролите, участвуют только ионы данного металла, т.е. когда металл находится в равновесии с собственными ионами в электролите. В этом случае скорости анодного и катодного процессов равны 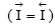 и потери массы (веса) металла нет (∆ me = 0), т.е. коррозии (растворения) металла не происходит (рисунок 3.2.1 (а)). Обратимый электродный потенциал металла (φ Me)обр можно не только измерить, но и рассчитать по термодинамическому уравнению Нернста.
и потери массы (веса) металла нет (∆ me = 0), т.е. коррозии (растворения) металла не происходит (рисунок 3.2.1 (а)). Обратимый электродный потенциал металла (φ Me)обр можно не только измерить, но и рассчитать по термодинамическому уравнению Нернста.
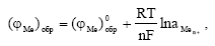
Необратимый электродный потенциал (φ Me) устанавливается, когда в процессе обмена, определяющего потенциал металла в электролите, участвуют не только ионы данного металла, но и другие ионы или атомы, причем анодный процесс осуществляется в основном ионами металла 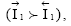 а катодный – другими ионами
а катодный – другими ионами 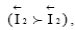 например водородными (рисунок 3.2.1, (б)). Эти потенциалы не подчиняются уравнению Нернста и поэтому не могут быть по нему рассчитаны, а определяются только опытным путем. Устойчивое во времени значение необратимого электродного потенциала металла, соответствующее равенству сумм скоростей анодного и катодного процессов, называется стационарным потенциалом металла. При этом значении потенциала, имеет место равенство:
например водородными (рисунок 3.2.1, (б)). Эти потенциалы не подчиняются уравнению Нернста и поэтому не могут быть по нему рассчитаны, а определяются только опытным путем. Устойчивое во времени значение необратимого электродного потенциала металла, соответствующее равенству сумм скоростей анодного и катодного процессов, называется стационарным потенциалом металла. При этом значении потенциала, имеет место равенство:
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
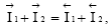
но в отличие от предыдущего случая mMe≠ 0, т.е. происходит электрохимическое растворение (коррозия) металла, т.к. 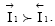 Отсюда следует, что скорости анодных и катодных процессов сильно влияют на величину стационарных необратимых электродных потенциалов и скорости электрохимической коррозии. Таким образом, при установлении на металле необратимого электродного потенциала происходит электрохимическое растворение металла, состоящее из двух электродных процессов:
Отсюда следует, что скорости анодных и катодных процессов сильно влияют на величину стационарных необратимых электродных потенциалов и скорости электрохимической коррозии. Таким образом, при установлении на металле необратимого электродного потенциала происходит электрохимическое растворение металла, состоящее из двух электродных процессов:
1) анодного процесса – образования гидратированных ионов металла в электролите и электронов на поверхности металла в соответствии с уравнением реакции;
2) катодного процесса – ассимиляции электронов какими либо ионами (кроме ионов данного металла) или молекулами раствора (деполяризаторами Д), способными к восстановлению по реакции: 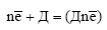
Способность иона посылать свои ионы в раствор характеризуются количественно значением обратимого потенциала металла в данных условиях, т.е. Me (φ Me)обр = (φ А)обр. Способность данного деполяризатор (Д) восстанавливаться, т.е. осуществлять катодный процесс ассимиляции электронов, характеризуется количественно значением обратимого потенциала данной катодной окислительно – восстановительной реакции (φ К)обр
К необратимым электродным потенциалам относятся потенциалы многих металлов в растворе собственных ионов (Fe, Al, Мg, Cr, Ti и др.), которые не подчиняются уравнению Нернста, и потенциалы всех металлов в растворах чужеродных ионов (H2O, NaCl, H2SO4 и др.), в которых в большинстве практических случаев они находятся.
Величина необратимых электродных потенциалов металлов определяется как внутренними, связанными с самим металлом (природа металла, физико-химическое состояние, структура, присутствие на поверхности пленок адсорбированных веществ и т.д.), так и внешними, связанными с электролитом и физическими условиями (химическая природа растворителя, природа и концентрация ионов в растворе, температура, давление и т.д) факторами.
|
|
