
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Обратимые и необратимые электродные потенциалы металлов
|
|
Электрохимическая коррозия металлов представляет собой самопроизвольное разрушение металлических материалов вследствие электрохимического воздействия их с окружающей электролитически проводящей средой, при которой ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от величины электродного потенциала металла. Этот тип коррозии более распространен. Он имеет место при взаимодействии металлов с жидкими электролитами (водой, водными растворами солей, кислот и щелочей, расплавленными солями и щелочами), и является гетерогенной электрохимической реакцией электролитов с металлами.
Причиной ее возникновения является химическая, энергетическая и другие виды неоднородности поверхности любого металла или сплава, т.е. разделение на катодные и анодные участки. Последние, имея очень малые размеры и чередуясь друг с другом, в токопроводящей среде представляют собой совокупность огромного числа короткозамкнутых микрогальванических элементов, поэтому электрохимическую коррозию часто называют гальванической коррозией.
Выделяют три основные причины, создающие неоднородность в системе металл – электролит, а следовательно, и возникновение коррозионных микроэлементов:
1) Неоднородность металлической фазы (неоднородность сплава по химическому и фазовому составам, наличие примесей в металле, пленок на его поверхности и др.);
2) Неоднородность жидкой фазы (различная концентрация в электролите ионов данного металла и растворенного кислорода на отдельных участках контакта фаз, разница в рН отдельных зон объема электролита и др.);
3) Неоднородность наложения внешних условий (неоднородная температура отдельных участков поверхности металла, различный уровень механических напряжений в одной и той же детали и др.).
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
В системах возможно возникновение не только микрокоррозионных, но и макрокоррозионных гальванических элементов. Например, при контакте с электролитом двух соприкасающихся друг с другом деталей, изготовленных из металлов различной активности (контактная коррозия).
Механизм электрохимической коррозии сводится к функционированию этих макро – и микрокоррозионных элементов. Поэтому процессы электрохимической коррозии аналогичны процессам, протекающим в химических источниках тока. Основное отличие от них – это отсутствие внешней цепи. Электроны в процессе коррозии не выходят из корродирующего металла, а перемещаются внутри его анодных участков к катодным.
Процесс электрохимической коррозии представляет собой совокупность двух сопряженно – протекающих на поверхности металла реакций:
а) анодной «А» (сопровождающейся окислением металла «Ме» на его анодных участках):
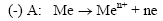
б) катодной «К», (сопровождающейся восстановлением окислителя «Оф» на его катодных участках с образованием его восстановленной формы «Вф»);
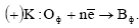
Окислители, восстанавливающиеся на катодных участках, называются деполяризаторами. Наиболее часто встречающимися деполяризаторами являются молекулы и O2, Cl2, ионы H+, Fe3+, NO3 - др.
Основными катодными реакциями при электрохимической коррозии металлов и сплавов являются:
В нейтральной и щелочной среде (рН≥ 7)
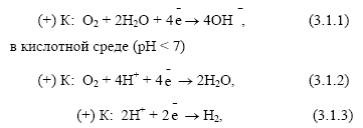
Коррозия с участием молекул кислорода (катодные реакции (3.1.1), (3.1.2)), сопровождающиеся его ионозацией называется коррозией с поглощением кислорода или коррозией с кислородной деполяризацией. С кислородной деполяризацией протекают следующие виды электрохимической коррозии: атмосферная в воде (пресной, морской), в растворах солей, и в аэрированных растворах органических кислот, подземная и др.
Коррозия с участием ионов водорода, сопровождающаяся его восстановлением, называется коррозией с выделением водорода, или коррозией с водородной деполяризацией, (катодная реакция 3.1.3).
При электрохимической коррозии происходит перемещение ионов в электролите и электронов внутри металла. Все это первичные процессы. Кроме них в процессе электрохимической коррозии протекают еще и вторичные процессы – процессы химического взаимодействия продуктов первичных процессов друг с другом, с электролитом, с растворимыми в нем газами с образованием вторичных продуктов, например, труднорастворимых гидроксидов, фосфатов металлов и др.:
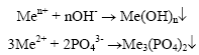
Труднорастворимые вторичные продукты затрудняют доступ электролита к поверхности металла и тем самым снижают скорость электрохимической коррозии.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
|
|
