
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Потенциалы металлических и газовых электродов
|
|
eг.э. = jк - ja, где
jк – потенциал положительного электрода (в элементе катод);
ja – потенциал отрицательного электрода (в элементе анод).
Если потенциал одного из электродов принять равным 0, то относительный потенциал второго электрода будет равен ЭДС элемента.
 Таким образом можно определить относительный потенциал любого электрода.
Таким образом можно определить относительный потенциал любого электрода.
| Рис.16. Водородный электрод |
В настоящее время за 0 принят потенциал стандартного водородного электрода (рис.16.)
Равновесие на водородном электроде:
2H+ + 2℮ = H2.
Для определения потенциалов электродов по водородной шкале собирают гальванический элемент, слева – водородный электрод, справа – измеряемый электрод:
H2, Pt | H+ || Меn+ | Ме
eг.э. = jп - jл.
Т.к. jл = 0 => eг.э.= jп = jМеn+/ Ме.
Используем уравнение (5):
 |
RT
 jМеn+/ Ме = j0Меn+/ Ме + ∙ lnaМеn+ —
jМеn+/ Ме = j0Меn+/ Ме + ∙ lnaМеn+ —
NF
уравнение Нернста для потенциала металлического электрода.
При Т = 298К, подставляя значения R и F, получаем
 0, 059
0, 059
 jМеn+/ Ме = j0Меn+/ Ме + ∙ lgaМеn+
jМеn+/ Ме = j0Меn+/ Ме + ∙ lgaМеn+
n
Для разбавленных растворов a» c.
j0Меn+/ Ме – стандартный потенциал металлического электрода.
Стандартным потенциалом металлического электрода называют потенциал этого электрода в растворе собственных ионов с активностью их, равной 1.
Ряд напряжений металлов:
| Li | Rb | K | Ba | Sr | Ca | Na | Mg | Al | Mn | Zn | Cr | Fe | |
| -3.02 | -2.99 | -2.92 | -2.90 | -2.89 | -2.87 | -2.71 | -2.34 | -1.67 | -1.05 | -0.76 | -0.71 | -0.44 | |
| Cd | Co | Ni | Sn | Pb | H | Sb | Bi | Cu | Hg | Ag | Pd | Pt | Au |
| -0.40 | -0.29 | -0.25 | -0.14 | -0.13 | 0.0 | +0.20 | +0.23 | +0.24 | +0.79 | +0.80 | +0.83 | +1.20 | +1.42 |
Водородный электрод: H2, Pt | H+
2H+ + 2℮ = H2. 0, 059 a2H+

 При Т = 298К уравнение Нернста: j2H+/H2 = ∙ lg
При Т = 298К уравнение Нернста: j2H+/H2 = ∙ lg
2 PH2
Учитывая, что lg aH+ = -pH => j2H+/H2 = -0.0295∙ lg PH2 – 0.059pH.
Если PH2 = 1,
 |
j2H+/H2 = -0, 059PH
Кислородный электрод: O2, Pt | OH-
O2 + 2H2O +4℮ = 4OH-
При Т=298К уравнение Нернста:
0, 059 PO2 ∙ a2H2O

 jО2/ОH- = jоО2/ОH- + ∙ lg
jО2/ОH- = jоО2/ОH- + ∙ lg
4 а4ОН-
0, 059
 Т.к. aH2О = const, то значение ∙ lg a2H2O
Т.к. aH2О = const, то значение ∙ lg a2H2O
введем в joO2/OH-:
PO2
 jO2/OH- = joO2/OH- + 0, 0147∙ lg, где
jO2/OH- = joO2/OH- + 0, 0147∙ lg, где
a4OH-
jоО2/ОH- - стандартный потенциал кислородного электрода, равный 0, 401 В.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
KH2O
 Учитывая аOH- = и lg aH+ = -PH, получаем
Учитывая аOH- = и lg aH+ = -PH, получаем
aH+
jО2/ОH- = 1, 23 + 0, 0147∙ lgPO2 – 0, 059PH
 |
Если PO2 = 1, то jО2/ОH- = 1, 23 – 0, 059РН (рис.17).


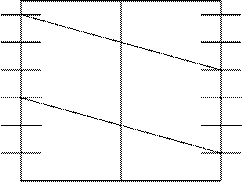 +1, 2 +1, 2
+1, 2 +1, 2
+0, 8 +0, 8
+0, 4 +0, 4
0 0
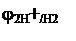 -0, 4 -0, 4
-0, 4 -0, 4
-0, 8 7 - 0, 8
2 4 6 8 10 12 РН
Рис.17. Зависимость потенциалов водородного и кислородного электродов от РН среды при РН2 = 1 и РО2=1 (101 кПа)
|
|
