
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Электродный потенциал. На границе металл – раствор возникает ДЭС – двойной электрический слой
|
|
| На границе металл – раствор возникает ДЭС – двойной электрический слой. Между металлом и раствором возникает разность потенциалов – электродный потенциал. |
 - +
- +
- +
металл - + раствор
- +
-
Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом:
Ме = Меn+ + n℮; jМеn+./Ме.
18.2. Гальванический элемент Даниэля – Якоби
На поверхности цинковой пластины:
Zn = Zn2+ + 2℮.
На поверхности медной пластины:
Cu = Cu2+ + 2℮.
Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, электроны будут переходить от Zn к Cu. В раствор перейдет дополнительное количество ионов Zn и произойдет разряд ионов Cu. При работе гальванического элемента Даниэля – Якоби протекают следующие процессы:
1) реакция окисления Zn: Zn – 2℮ ® Zn2+ (анодный процесс, Zn – анод);
2) реакция восстановления ионов меди Cu2+: Cu2+ + 2℮ ® Cu0 (катодный процесс, Cu – катод);
3) движение электронов во внешней цепи;
4) движение ионов в растворе: анионов (SO2-4) к аниону, катионов (Cu2+, Zn2+) к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента (рис.15.)
Токообразующая реакция:
Zn + Cu2+ = Cu + Zn2+.
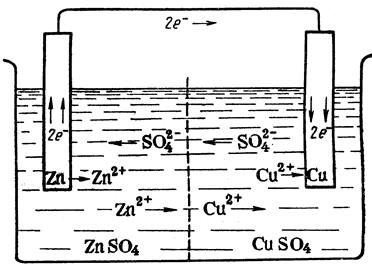
| Рис.15. Схема движения ионов и электронов при работе медно-цинкового гальванического элемента |
Схема записи гальванического элемента:
Zn | Zn2+ || Cu2+ |Cu
|
|
