
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Способы получения
|
|
1. Действием аммиака на галогенпроизводные (реакция Гофмана).
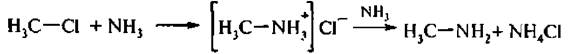
Первоначально аммиаке хлористым метилом образует соль, которая под действием избытка аммиака превращается в первичный амин.
Метилирование может протекать и дальше. Образовавшийся первичный амин реагирует со следующей молекулой галогеналкана и т. д. В результате образуется вторичный амин, затем третичный и соль четвертичного аммониевого основания:
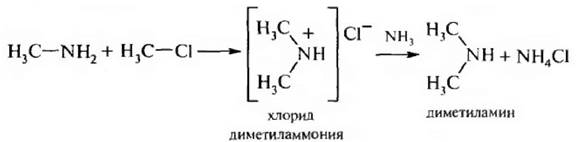
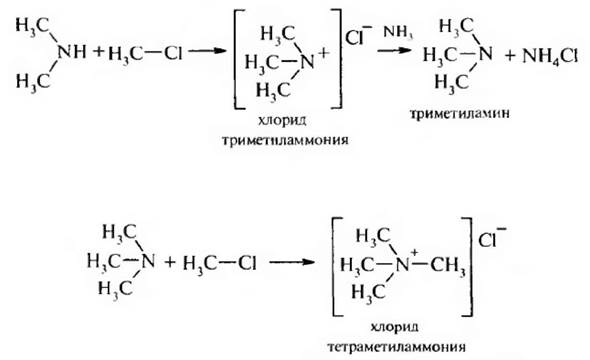
Преимущество этого метода – это простота, недостаток – трудно разделить образующиеся амины, однако для промышленного производства этот метод очень удобен.
2. Перегруппировка Гофмана. При обработке незамещенных амидов карбоновых кислот гипобромитом натрия (смесь брома и гидро-ксида натрия) образуются первичные амины, при этом углеродная цепь укорачивается на один атом:
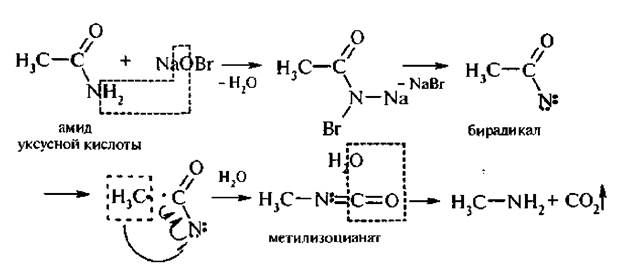
Этот способ имеет большое значение и дает возможность получать чистые амины.
3. Способ Габриэля. Конденсацией фталимида калия с алкилгалогенидами с последующим гидролизом получают только первичные алифатические амины:
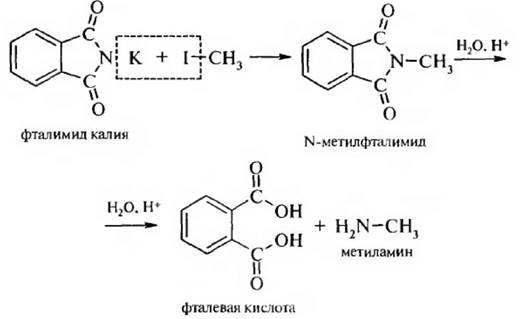
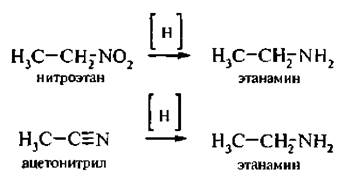
4. При восстановлении нитроалканов и нитрилов образуются первичные амины:
Физические свойства
Низшие амины (метиламин и этил амин) – газы, с увеличением количества атомов углерода – жидкости, высшие амины – твердые вещества. Они обладают аммиачным запахом, а также запахом соленой сельди.
Низшие амины хорошо растворимы в воде, с увеличением молекулярной массы растворимость снижается, а высшие амины не растворимы в воде.
Химические свойства
Реакционная способность алифатических аминов определяется наличием у атома азота неподеленной пары электронов, которая обуславливает то, что амины активно выступают в роли нуклеофилов, а также являются сильными органическими основаниями.
Основность. Являясь производными аммиака, алкиламины подобно аммиаку проявляют ярко выраженные основные свойства, которые обусловлены способностью атома азота с неподеленнои электронной парой к присоединению протона с образованием иона замещенного аммония. При этом амины в 10 раз сильнее, чем аммиак. Это связано с изменением электронной плотности на атоме азота.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Алкильные радикалы увеличивают электронную плотность на атоме азота за счет проявления +I-эффекта, что приводит к заметному усилению основности. Поэтому можно предположить, что третичные ал килами ны, имеющие три донорных заместителя, будут более сильным и основаниями, чем вторичные, а вторичные, в свою очередь, более сильными, чем первичные и аммиак:

Такая закономерность изменения основности алкиламинов наблюдается в газовой фазе и в неводных растворах. В водных растворах наряду с электронными эффектами заместителей влияет и сольватационный эффект растворителя.
В результате совместного проявления этих двух факторов основность третичных аминов в водных растворах ниже основности первичных и вторичных:
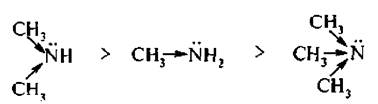
1. Водные растворы алкиламинов имеют щелочную среду:

2. С кислотами алкиламнны образуют соли алкиламмония:

3. Взаимодействие с галогеналканами (реакция алкилирования). См. способы получения (peaкиия Гофмана).
4. Взаимодействие аминов с ацилирующими реагентами (реакция аицлирования). Первичные и вторичные алкил амины вступаютвреакцию с функциональными производными карбоновых кислот – галогенангидридами, ангидридами и сложными эфирами, образуя N-за мешенные амиды карбоновых кислот:
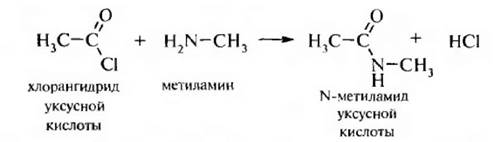
В процессе реакции атом водорода при азоте в молекуле амина замещается на остаток карбоновой кислоты. Третичные амины не содержат при атоме азота водорода и поэтому в реакцию ацилирования не вступают.
5. Взаимодействие с азотистой кислотой. Реакция с HNO2 применяется для идентификации алифатических аминов.
Первичные алкиламины под действием азотистой кислоты превращаются в спирты с выделением азота и воды:
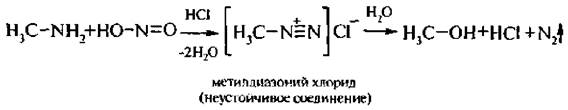
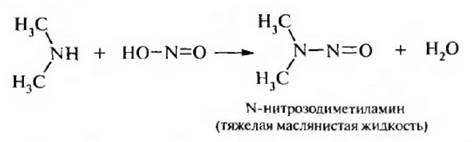
Вторичные алкиламины в реакции с азотистой кислотой образуют N-нитрозоамины:
Третичные амины при обычной температуре с азотистой кислотой не реагируют:

6. Изонитрилъная реакция. Специфическая реакция обнаружения первичных аминов. При нагревании первичных алкиламинов с хлороформом в присутствии щелочи в спиртовой среде образуются изонитрилы (изоцианиды):
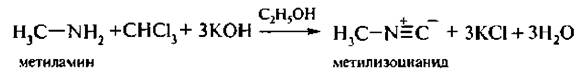
Изонитрилы имеют очень неприятный запах. Эта реакция очень чувствительна.
7. Реакция окисления. Первичные алкиламины при окислении озоном образуют нитроалканы:
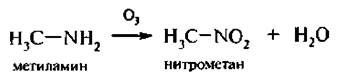
Под действием сильных окислителей первичные алифатические амины образуют смесь вешеств, в которой преобладают альдегиды, а вторичные – тетразамещенные гидразины.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
При окислении третичных аминов действием Н2O2 или пероксикислотами RCOOOH образуются N-оксиды аминов:

N-Оксиды аминов являются биологически активными соединениями.
АМИНЫ АРОМАТИЧЕСКОГО РЯДА (АРИЛАМИНЫ)
|
|
