
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Конформационная изомерия
|
|
Конформанионная (поворотная) изомерия обусловлена вращением атомов или атомных групп вокруг одной или нескольких простых σ -связей. В результате вращения вокруг С–С-связей молекулы могут иметь различные пространственные формы, которые называют конформациями.
Например, молекула этана вследствие врашения вокруг углерод-углеродной связи может принимать бесконечное множество конформаций. каждая из которых характеризуется определенным значениемпотенциальной энергии. Две крайние конформации называют заслоненной и заторможенной.
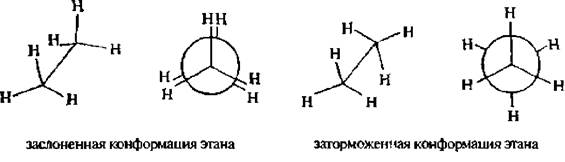
Для представления конформаний на плоскости используют формулы Ньюмена и перспективные формулы.
В заслоненной конформации этана атомы водорода метильных групп, если смотреть вдоль связи углерод-углерод, расположены друг за другом, В заторможенной – атомы водорода одной метильной группы максимально удалены от атомов водорода другой. Между заслоненной и заторможенной конформацией молекула в процессе вращения принимает множество скошенных конформаций.
Каждая из конформаций молекулы этана характеризуется различной потенциальной энергией. Заслоненная конформация имеет максимальную энергию, а заторможенная – минимальную.
Энергетическая равноценность различных конформаций объясняется существованием в молекуле так называемого торсионного напряжения (напряжения Питцера), которое обусловлено взаимодействием (отталкиванием) электронных облаков противостоящих связей. В заслоненной конформаиии противостоящие связи максимально сближены, поэтому взаимодействие между ними наибольшее. Разность энергий заслоненной и заторможенной конформаций называется энергетическим барьером вращения. Для этана энергетический барьер невелик, он составляет около 12 кДж/моль и легко преодолевается молекулой при обычных температурах за счет энергии теплового движения.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
При вращении вокруг С2–С3 связи в н-бутане возможны четыре крайние конформаций, из которых две заторможенные и две заслоненные:
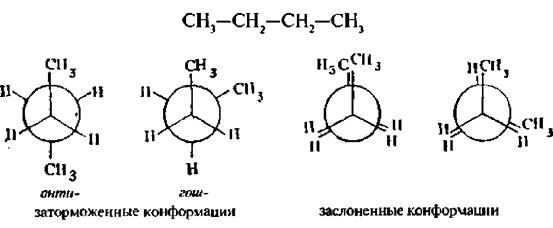
Заторможенная конформация. в которой метильные группы (объемные заместители) максимально удалены друг от друга, получила название анти -конформаиии. Другая заторможенная конформация называется гош -конформаиией.
Заторможенная гош-конформация обладает несколько большей потенциальной энергией (за счет метил-метильного взаимодействия), чем анти -конформация (в ней взаимодействие между метилами вообще отсутствует).
Хотя в молекуле н -бутана существует свободное вращение вокруг центральной С–С связи, однако в каждый момент времени большая часть молекул представлена наиболее энергетически выгодной конформацией.
Конформации с наименьшим запасом энергии называют конформерамн или конформационными (поворотными) изомерами.
Так, н -бутан при 25 *С существует примерно на 70 % в форме анти-конформера и на 30 % гош -конформера.
В отличие от конфигурационных изомеров, конформеры превращаются друг в друга без разрыва химических связей и не поддаются разделению. Они обнаруживаются только физико-химическими методами.
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ И РЕАГЕНТОВ
Наиболее широко в органической химии используют классификацию химических реакций, основанную на представлениях об их механизме. Учитывается способ разрыва химической связи, природа интермедиатов, природа реагента и другие факторы.
В соответствии со способом разрыва связи реакции делятся на
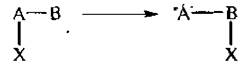
гемолитические (симметричный разрыв двухэлектронной ковалентной связи с образованием двух свободных радикалов A·|·В → А· + В·),
гетеролитические (несимметричный разрыв связи, приводящий к появлению двух частице противоположными зарядами A: |В → А– + В+) и
перициклические (молекулярные).
По природе интермедиатов реакции могут быть ионными, радикальными и др.
Ионные реакции осуществляются при участии заряженных частиц. К этому же типу относятся многие органические реакции, интермедиатами в которых являются карбкатионы или карбанионы, образующиеся в результате гетеролитического распада исходных веществ,
Карбкатионами называют органические катионы, содержащие положительно заряженный атом углерода. Атом углерода в карбкатионе, несущий положительный заряд, находится в sp2-гибридном состоянии: три его σ -связи расположены в одной плоскости, а p -атомная орбиталь является вакантной.
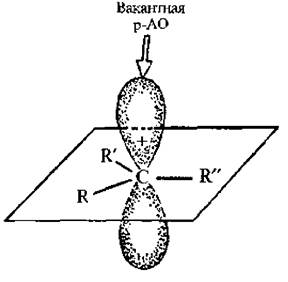
Карбанионами называют органические анионы, содержащие отрицательно заряженный атом углерода, т. е. трехвалентный атом углерода с неподеленной парой электронов,
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Неподеленная пара электронов находится нa sp3-гибридизованной атомной орбитали в случае карбанионов ряда алкинов, а карбанионы, в которых неподеленная пара электронов сопряжена с кратной связью, содержат эту пару электронов на p -атомной орбитали.
Радикальные реакции протекают с участием свободных радикалов.
Свободными радикалами называют незаряженные частицы, содержащие неспаренный электрон (одноэлеклронную атомную орбиталь).
Неспаренный электрон может находиться на sp3 -гибридизованной атомной орбитали или на p -атомной орбитали. В зависимости от этого свободный радикал может иметьтетраэдрическое или плоское строение.
Плоское строение имеют простые алкильные радикалы (неспаренный электрон находится нар-АО).
Третичные алкильные радикалы имеют тетраэдрическое строение (неспаренный электрон занимает sp3 -гибридную орбиталь).
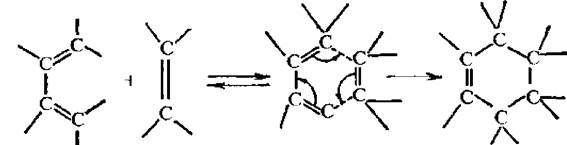
Периииклические реакции протекают без образования промежуточных активных частиц, в таких реакциях происходит синхронный разрыв старых и образование новых химических связей.
Например:

Реакции, протекающие по ионному механизму, делят на нуклеофильные и электрофильные в зависимости от природы атакующего реагента.
Нуклеофнльными называют реагенты, которые предоставляют электронную пару для образования химической связи с субстратом. К нуклеофильным реагентам относятся: молекулы, содержащие хотя бы одну неподеленную пару электронов,
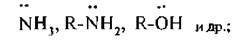
ионы, несушие отрицательный заряд (анионы).

молекулы, имеющие центры с повышенной электронной плотностью,

Нуклеофилы способны образовывать ковалентную связь с субстратом, атакуя в его молекуле центры с пониженной электронной плотностью.
Электрофильными называют реагенты, принимающие электронную пару от субстрата при образовании с ним химической связи. К электрофильным реагентам относят катионы (Н+, NO2+, Cl+ и др.), нейтральные молекулы, имеющие вакантную орбиталь (АlСl3, FeBr3 и др.) или центры с пониженной электронной плотностью,
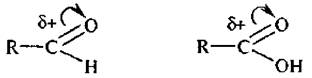
галогены Сl2, Вr2, I2 (в присутствии кислот Льюиса).
Электрофильные реагенты способны образовывать ковалентную связь с субстратом, атакуя в его молекуле центры с повышенной электронной плотностью.
Заслуживает внимания широко используемая в органической химии классификация химических реакций по формальным признакам:
1. Реакции присоединения обозначаются символом «А» (от англ. addition – присоединение).
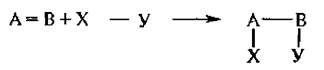
Эти реакции характерны для соединений, имеющих кратные связи. Реакции присоединения могут протекать по следующим возможным механизмам:
а) электрофильное присоединение (AE);
б) нуклеофильное присоединение (АN);
в) свободнорадикальное присоединение (AR);
г) молекулярное (синхронное) присоединение.
2, Реакции замещения обозначаются символом «S» (от англ, substitution – замещение).

Они характерны для всех классов органических соединений и могут протекать по следующим механизмам:
а) электрофильное замешение (SE):
б) нуклеофильное замещение (SN);
в) свободнорадикальное замешение (SR).
3. Реакции отщепления (элиминирования) обозначаются символом «Е» (от англ, elimination – отщепление)
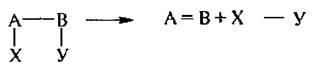
Реакции отщепления характерны для галогенопроизводных углеводородов, спиртов, гетерофункциональных карбоновых кислот (галогено-. гидрокси-, аминокислот).
4. Перегруппировки.
Происходит переход (миграция) отдельных атомов или групп атомов от одного фрагмента молекулы к другому.
5. Реакции окисления и восстановления. Сопровождаются изменением степени окисления атома углерода, являющегося реакционным центром. Механизм реакции окисления органических веществ достаточно сложен.
По количеству молекул, принимающих участие в лимитирующей стадии, различают мономолекулярные и биомолекулярные реакции (обозначают цифрами 1 и 2 соответственно). В лимитирующей (самой медленной) стадии мономолекулярной реакции принимают участие молекулы одного реагента, в бимолекулярной – молекулы двух реагентов.
Обширную группу химических реакций составляют каталитические реакции, осуществление которых возможно только в присутствии катализатора.
Большое значение имеют реакции полимеризации, заключающиеся в образовании высокомолекулярного вещества (полимера) из низкомолекулярных веществ (мономеров).
|
|
