
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Конфигурационная изомерия
|
|
К конфигурационной относится оптическая и геометрическая изомерия.
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
В 1815 г. Ж. Био открыл существование оптической активности для органических соединений. Было установлено, что некоторые органические соединения имеют способность вращать плоскость поляризации поляризованного света. Вещества, которые обладают такой способностью, называются оптически активными.
Если луч обычного света, в котором, как известно, электромагнитные колебания распостраняются в разных плоскостях, перпендикулярных к направлению его распространения, пропустить через призму Николя, то выходящий свет будет плоскополяризованным, В таком луче электромагнитные колебания совершаются только в одной плоскости. Эту плоскость называют плоскостью поляризации (рис. 3.2).
При прохождении поляризованного луча света через оптически активное вещество плоскость поляризации поворачивается на определенный угол α вправо или влево. Если вещество отклоняет плоскость поляризации вправо (при наблюдении навстречу лучу), его называют правовращающим, если влево – левоврашаюшим. Правое вращение обозначают знаком (+), левое – знаком (-).
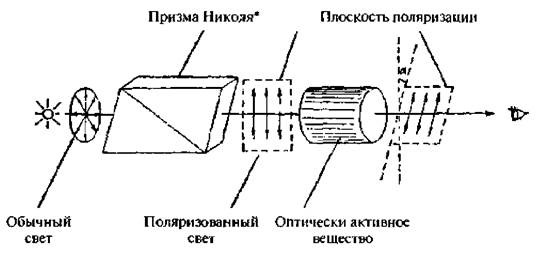
Рис. 3.2. Схема образования поляризованного света и врашения плоскости поляризаиии оптически активным веществом
Оптическую активность измеряют с помощью приборов, называемых поляриметрами.
Явление оптической активности распространено среди органических веществ, особенно среди природных (гидрокси- и аминокислот, белков, углеводов, алкалоидов).
Оптическая активность большинства органических соединений обусловлена их строением.
Одной из причин возникновения оптической активности органических молекул является наличие в их структуре sp3-гибридизированного атома углерода, связанного с четырьмя разными заместителями. Такой атом углерода называется хиральным или асимметрическим. Часто для него применяют более общее название – хиральный центр. В структурных формулах асимметрический атом углерода принято обозначать звездочкой – С*:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
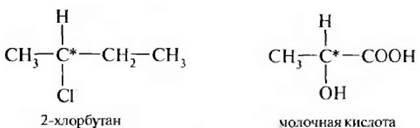
Соединения, содержащие один асимметрический атом углерода, существуют в виде двух изомеров, относящихся друг к другу как предмет к своему зеркальному отображению. Такие изомеры называются энантиомерами.
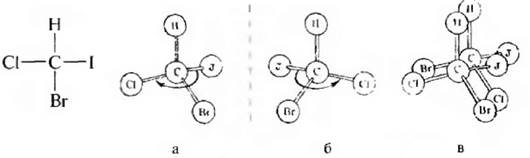
Рис. 3.3. Модели энантиомерных молекул бромиодхлорметана
Для изображения пространственного строения оптических изомеров на плоскости могут быть использованы стереохимические формулы. Например, энантиомеры бутанола-2, изображенные с помощью стереохимических формул, имеют следующий вид:

Однако стереохимические формулы не всегда удобны для описания пространственного строения молекул. Поэтому чаше всего оптические изомеры изображают на плоскости с помошью проекционных формул Фишера. Например, так выглядят энантиомеры 2-бромбутана, изображаемые с помошью проекции Фишера.

Энантиомеры очень похожи друг на друга, но тем не менее не тождественны. Они имеют одинаковый состав и последовательность связывания атомов в молекуле, но отличаются друг от друга относительным расположением их в пространстве, т. е, конфигурацией. В том, что эти молекулы разные, легко убедиться при попытке наложения их моделей друг на друга.
Свойство молекул не совмещаться со своим зеркальным изображением называется хиральностью (от греч, cheir– рука), а также молекулы называют хиральными. Наглядным примером могут служить левая и правая руки, которые являются зеркальным отражением друг друга, но вместе с тем их нельзя совместить. Молекулы, которые совместимы со своим зеркальным изображением называют ахиральными.
Хиральность молекул является обязательным условием для проявления веществом оптической активности.
Как установить является ли молекула хиральной? Хиральность молекулы можно легко обнаружить путем построения модели молекулы и модели ее зеркального изображения с последующим их совмещением. Если модели не совмещаются – молекула хиральна, если совмещаются – ахиральна. Такой же вывод можно сделать и на основе стереохимических формул молекул по наличию ил и отсутствию элементов симметрии, так как причиной оптической активности органических соединений является их асимметрическое строение. Поскольку молекула представляет собой трехмерное образование, ее строение можно рассматривать сточки зрения симметрии геометрических фигур. Основным элементами симметрии являются плоскость, центр и ось симметрии. Если в молекуле отсутствует плоскость симметрии, то такая молекула хиральна.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Энантиомеры обладают одинаковыми физическими и химическими свойствами (температура кипения, температура плавления, растворимость, электропроводность и другие константы будут одни и те же), вращают плоскость поляризации поляризованного луча на один и тот же по величине угол, но имеются и различия.
Энантиомеры отличаются знаком вращения, один вращает плоскость поляризации поляризованного луча влево, другой – вправо; они с различной скоростью реагируют с другими хиральными соединениями, а также имеется различие в физиологическом действии. Например, лекарственный препарат левомицин – антибиотик широкого спектра действия. Если его эффективность принять за 100, то правовращающая форма составит только 2 % от эффективности левовращающсй формы.
Если молекула имеет один асимметрический атом, то она существует в виде двух изомеров, если же молекула имеет несколько асимметрических атомов углерода, то число возможных изомеров увеличивается. Число оптических изомеров определяют по формуле:
N = 2n,
где N – число изомеров; п – число асимметрических атомов углерода.
Так при наличии в молекуле двух асимметрических атомов углерода число изомеров равно 22 = 4, трех – 23 = 8, четырех – 24 = 16 и т. д.
Например, бромяблочная кислота, содержащая два асимметрических атома углерода, существует в виде четырех стереоизомеров (I–IV).
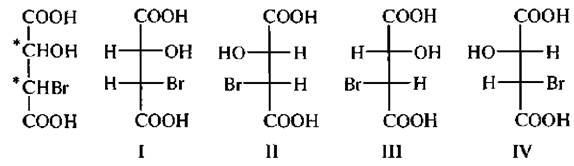
Стереомеры I и II, а также III и IVотносятся друг к другу как предмет и его зеркальное изображение и являются энантиомерами.
Стереоизомеры 1 и III, 1 и IV, а также II и HI, Н и IV не являются зеркальными отображениями друг друга, они отличаются конфигурацией при одном из асимметрических атомов углерода. Такие стереоизомеры называют диастереомерами. В отличие от энантиомеров диастереомеры имеют различные физические и химические свойства.
Для соединений, содержащих два хиральных атома углерода, связанных с одинаковыми заместителями, общее число стереоизомеров уменьшается до трех. Например, винная кислота должна существовать в виде четырех стереоизомеров (22 = 4), а известно лишь три. Это обусловлено появлением у одного из стереоизомеров такого элемента, как плоскость симметрии.
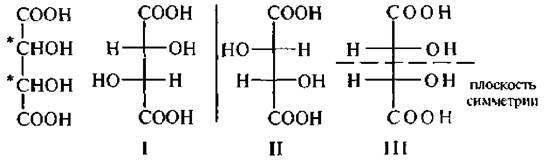
Стереомеры 1 и II являются энантиомерами. Стереоизомер III (мезо-форма) является оптически неактивным. Молекула мезовинной кислоты ахиральна. Каждый энантиомер винной кислоты по отношению к мезо-форме является диастереомером.
Номенклатура оптических изомеров
В номенклатуре наряду с названием соединения указывают также конфигурацию и направление вращения плоскости поляризованного света. Последнее обозначают знаком (+) для правовращающего изомера или знаком (-) для левовращающего изомера.
Для обозначения конфигурации оптических изомеров существуют D, L- и R, S -стереохимические системы.
D, L-система обозначения конфигурации. Установить абсолютную конфигурацию молекул оказалось для химиков довод ьно сложной задачей. Впервые это удалось лишь в 1951 г. методом рентгеноструктур-ного анализа. До этого времени конфигурацию оптических изомеров устанавливали методом сравнения со специально выбранным стандартным веществом. Такая конфигурация получила название относительной. В 1906 г. русским ученым М.А. Розановым в качестве стандарта для установления относительной конфигурации был предложен глицериновый альдегид,
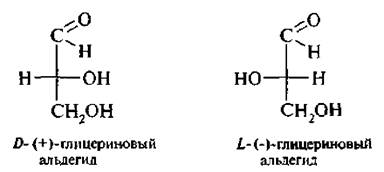
Для правовращающего изомера выбрали формулу Фишера, в которой гидроксильная группа у хирального атома углерода находится справа, а для левоврашаюшего – слева. Конфигурация правовращающего изомера обозначается буквой D а левоврашаюшего – L.
С использованием в качестве эталона сравнения глицеринового альдегида была разработана D, L-система стереохимической классификации хиральных соединений, т. е. отнесения соединений соответственно к D- или L-стереохимическому ряду
D, L-система главным образом применяется в ряду многоатомных спиртов, гидрокси-, аминокислот и углеводов:
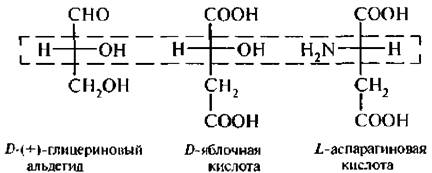
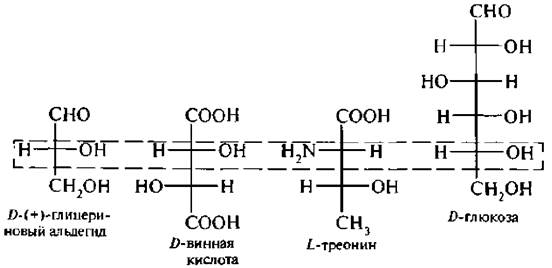
Для соединений с несколькими асимметрическими атомами углерода, таких как α -пироксикислоты, α -аминокислоты, винные кислоты, конфигурацию условно определяют по верхнему асимметрическому атому углерода (по гндроксикислотному ключу), в то время как в молекуле углеводов конфигурацию устанавливают (условно) по нижнему асимметрическому атому углерода.
R, S -система обозначения конфигурации. D, L- система оказалась практически неприемлемой для соединений мало похожих на глицериновый альдегид. Поэтому R Каном, К. Ингольдом и В. Прелогом была предложена R, S- система обозначения абсолютной конфигурации оптических изомеров. R, S- система построена на определении старшинства заместителей у хирального центра.
Старшинство заместителей определяется величинами атомных номеров элементов. Чем больше атомный номер, тем старше заместитель. Например» в молекуле бромйодхлорметана старшинство заместителей уменьшается в ряду:
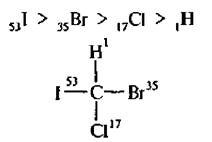
После установления старшинства заместителей модель молекулы ориентируют так, чтобы заместитель с наименьшим порядковым номером был направлен в сторону, противоположную глазу наблюдателя. Если старшинство трех остальных заместителей убывает по направлению часовой стрелки, то молекула имеет конфигурацию, обозначаемую буквой R (отлат, rectus – правый), а если старшинство заместителей убывает против часовой стрелки, конфигурацию обозначают буквой S (отлат. sinister–левый). Например, для молекулы бромйодхлорметана:
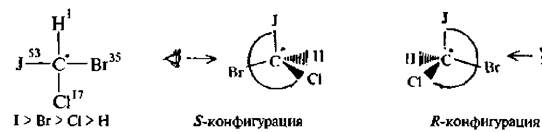
Рис 3, 4. Определение конфигурации по R, S-системе для молекулы бромйодхлорметана
Рассмотрим определение старшинства заместителей и конфигурации для более сложных молекул на примере молочной кислоты (рис. 3.4). Уже по первому слою (8O, бС, 1Н, 6С) становится понятно, что старшим заместителем является группа ОН, а младшим – водород. Для выяснения старшинства двух других заместителей СН^ и СООН с одинаковым атомным номером (6С) по первому слою, необходимо рассмотреть второй слой. Сумма атомных номеров второго слоя СН3-группы= 1 + 1 + 1 = 3, а группы СООН = 8 + 8*2 = 24. Значит-СООН-группа старше группы –СН3 Старшинство заместителей вокруг асимметрического атома углерода в молекуле молочной кислоты уменьшается в ряду: ОН > СООН > СН3 > Н
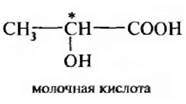
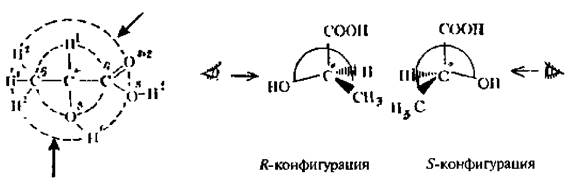
Рис. 3.5. Определение конфигурации по R, S-системе для молочной кислоты
Рацематы. Смесь равных количеств энантиомеров оптически неактивна, ее называют рацемической смесью (рацематом). Рацематы отличаются от индивидуальных энантиомеров физическими свойствами, они могут иметь различную температуру плавления, растворимость; отличаются спектральными характеристиками.
На практике чаще приходится сталкиваться не с индивидуальными энантиомерами, а рацематами, которые образуются в результате химических реакций, протекающих с образованием хиральных молекул.
Для разделения рацематов на энантиомеры пользуются тремя методами:
1. Механический метод. В результате кристаллизации некоторых оптически активных соединений могут образовываться две формы кристаллов, похожих друг на друга как предмет и его зеркальное отображение. Их можно отделить под микроскопом препаративной иглой (механически).
2. Биохимический метод основан на том, что определенные виды микроорганизмов предпочитают одну из энантиомерных форм и поедают ее, вторая остается и может быть легко выделена.
3. Химический метод, В основе химического метода лежит перевод энантиомеров при помощи оптически активных реагентов в диа-стереомеры, которые уже отличаются друг от друга по физическим свойствам. Диастереомеры гораздо легче разделить.
Например, следует разделить рацемическую смесь двух кислот (А+ В), Для этого к смеси добавляют оптически активное основание (С). Между рацемической формой и оптически активным основанием протекает реакния
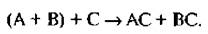
АС и ВС – это диастереомеры. Они обладают различной растворимостью и методом последовательной кристализации можно выделить два диастереомера отдельно.
Но так как АС и ВС образованы слабой органическом кислотой и основанием, то используют для их разложения минеральные кислоты.
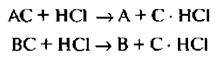
Таким образом получают чистые энантиомеры А и В.
ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ
Причиной возникновения геометрической изомерии является отсутствие свободного вращения вокруг σ -связи. Этот вид изомерии характерен для соединений, содержащих двойную связь, и для соединений алициклического ряда.
Геометрические изомеры это вещества, имеющие одинаковую молекулярную формулу, одинаковую последовательность связывания атомов в молекулах, но отличающиеся друг от друга различным расположением атомов или атомных групп в пространстве относительно плоскости двойной связи или плоскости цикла.
Причиной возникновения данного вида изомерии является невозможность свободного вращения вокруг двойной связи или σ -связей, образующих цикл.
Например, бутен-2 СН3–СН=СН–СН3 может существовать в виде 2-х изомеров, которые различаются расположениями метильных групп в пространстве относительно плоскости двойной связи.
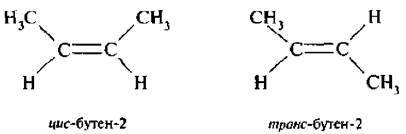
или 1, 2-диметилциклопропан существует в виде двух изомеров, которые различаются расположением метильных групп в пространстве относительно плоскости цикла:
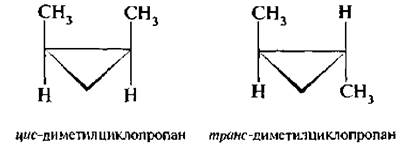
Для обозначения конфигурации геометрических изомеров используют цис-, транс-систему. Если одинаковые заместители расположены по одну сторону от плоскости двойной связи или цикла – конфигурацию обозначают цис-. если по разные стороны – транс-.
Для соединений, у которых при атомах углерода с двойной связью находятся различные заместители, применяют Z, E-систему обозначений.
Z, E-система является более обшей. Она применима к геометрическим изомерам с любым набором заместителей. В основе этой системы лежит старшинство заместителей, которое определяют у каждого атома углерода отдельно. Если старшие заместители из каждой пары расположены по одну сторону от двойной связи, конфигурация обозначается буквой Z(от нем. zusammen – вместе), если по разные стороны – буквой £ (от нем. entgegen – напротив).
Так для 1-бром-1-хлорпропена возможно два изомера:
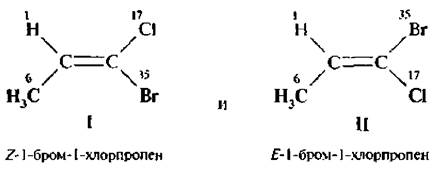
Старшим заместителем у одного атома углерода является метильная группа (заместители 1Н и 6СН3). а у другого – атом брома (заместители 17Сl и 35Вr). В изомере 1 старшие заместители расположены по одну сторону от плоскости двойной связи, ему приписывают Z-конфигурацию, а изомеру II Е-конфигурацию (старшие заместители расположены по разные стороны плоскости двойной связи).
Геометрические изомеры имеют разные физические свойства (температуру плавления и кипения, растворимость и т. д.), спектральные характеристики и химические свойства. Такое различие в свойствах позволяет довольно легко установить их конфигурацию с помощью физических и химических методов.
|
|
