
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Типы химических связей
|
|
Согласно принятой в настоящее время классификации существует несколько типов химической связи: ионная, ковалентная, водородная, металлическая и др. По способу образования химической связи различают две основные: ионную и ковалентную.
ИОННАЯ СВЯЗЬ
Ионная связь – характерна для атомов значительно отличающихся по электроотрицательности. Ионный тип связи характерен для неорганических соединений.
Рассмотрим, как осуществляется связь в хлориде натрия:

Хлор по сравнению с натрием обладает большей электроотрицательностью, то есть большим сродством к электрону. Вследствие этого электрон переходите внешней оболочки натрия на внешнюю оболочку хлора, при этом образуются положительный и отрицательный заряды, между которыми действуют силы электростатического притяжения. Ион натрия приобретает электронную конфигурацию неона, а нон хлора – конфигурацию аргона.
Соединения с ионной связью характеризуются относительно большим дипольным моментом, хорошей электропроводимостью, высокими температурами плавления.
КОВАЛЕНТНАЯ СВЯЗЬ
Ковалентная связь – основной тип связи в органических соединениях, характеризующийся увеличением электронной плотности меж ду химически связанными атомами в молекуле по сравнению с распределением электронной плотности в свободных атомах.
Ковалентная связь возникает между атомами, имеющими одинаковую или близкую по значению электроотрицательность. Для образования ковалентной связи каждый из атомов предоставляет по одному электрону, при этом образуется общая пара электронов, которая в равной степени принадлежит обоим атомам. На письме ковалентная связь изображается черточкой между атомами.
Классическим примером ковалентной связи является молекула метана:
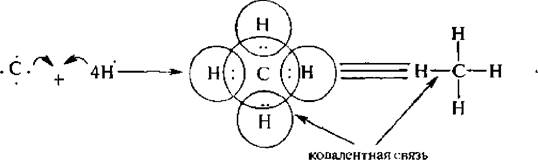
Атом углерода содержит на внешнем электронном уровне четыре валентных электрона и, чтобы доукомплектовать этот слой до октетной конфигурации, он образует четыре общие электронные пары с четырьмя атомами водорода.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
В зависимости от электроотрицательности атомов между которыми образовалась ковалентая связь, она может быть полярной или неполярной.
Если электроотрицательность атомов одинакова, то общая электронная пара находится на одинаковом расстоянии от ядра каждого из атомов, Такая связь называется ковалентной неполярной:
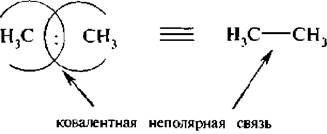
При возникновении ковалентной связи между атомами с различной электроотрицательностью общая электронная пара смещается к более электроотрицательному атому. В этом случае образуется ковалентная полярная связь.
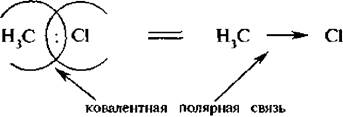
Стрелка в формуле указывает на полярность ковалентной связи. С помощью греческой буквы δ {«дельта») обозначают частичные заряды на атомах: δ + – пониженную, δ - – повышенную электронную плотность.
По числу электронных пар, образующих ковалентную связь, различают связи простые – с одной парой электронов и кратные – с двумя или тремя парами.
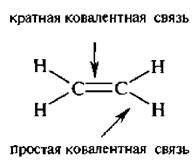
Основные характеристики ковалентной связи:
длина связи (расстояние между центрами атомов в молекуле);
энергия связи (энергия, которую необходимо затратить на разрыв связи);
полярность связи (неравномерное распределение электронной плотности между атомами, обусловленное различной электроотрицательностью);
поляризуемость (легкость, с которой смещается электронная плотность связи к одному из атомов под влиянием внешних факторов);
направленность (ковалентная связь, направленная до линии, соединяющей центры атомов).
Атомы некоторых элементов (кислорода, азота, серы, галогенов и др.) расходуют не все внешние электроны для формирования октетной оболочки. Такие электроны называют неподеленные, необобществленные или n-электроны.

Донорно-акцепторная связь или координационная – разновидность ковалентной связи, которая отличается способом образования.
Донор – атом, который должен иметь пару неполеленных электронов, а акцептором может быть любой атом (в том числе и протон), у которого не хватает до образования октета двух электронов.
Например, образование иона аммония протекает по донорно-акцепторному механизму. Ковалентная связь образуется за счет того, что атом азота (донор электронов) отдает неподеленную пару электронов на образование ковалентной связи протону (акцептору электронов):
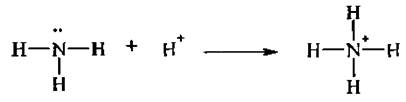
В результате образования связи атом кислорода (акцептор) приобретает отрицательный заряд, а атом азота (донор) – положительный. Такой вид связи обозначают следующим образом:
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Вновь образовавшаяся связь Н–N ничем не отличается от остальных связей Н–N, которые имелись у аммиака. Такая связь называется еще координационной.
Семи полярная связь – частный случай донорно-акдепторной связи. Она образуется между атомами, один из которых имеет неподеленную пару электронов, а другой содержит на внешнем энергетическом уровне шесть электронов (секстет), то есть имеет вакантную атомную орбиталь.
Рассмотрим образование семиполярной связи в молекуле оксида триметиламина:
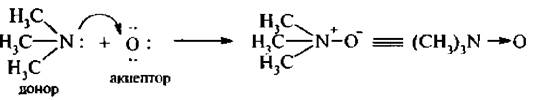

Соединения с семиполярной связью не проводят электрический ток, несмотря на наличие наряду с ковалентной связью и ионного взаимодействия.
ВОДОРОДНАЯ СВЯЗЬ
Водородная связь образуется в результате электростатического взаимодействия между атомом водорода, несущим дробный положительный заряд, и неподеленной парой электронов другого атома. Обычно такие атомы водорода называют активными.
Водородную связь графически изображают тремя точками:
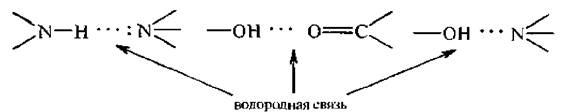
Водородная связь бывает внутримолекулярная и межмолекулярная.
Примером соединений с внутримолекулярной водородной связью
могут быть салициловый альдегид и о-хлорфенол.
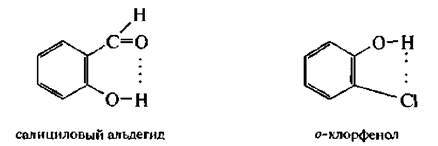
Межмолекулярные водородные связи (МВС) возникают между двумя или большим числом молекул с образованием димеров или ассоциатов:
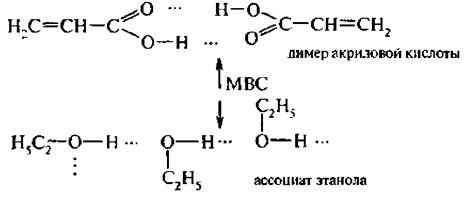
Водородная связь тем сильнее, чем более электроотрицателен элемент» с которым связан атом водорода. По сравнению с обычной ковалентной связью (Е = 340 – 360 кДж/моль) энергия водородной связи невелика (10 – 40 кДж/моль), но наличие этого вида связи существенно отражается на физико-химических свойствах веществ. За счет межмолекулярной водородной связи повышается температура плавления о-нитрофенола (114 °С), по сравнению с п-нитрофенолом (45 °С), Образование ассоциатов этиловым спиртом сказывается на его температуре кипения (78 °С), которая значительно выше, чем у неспособного образовывать водородную связь диметилового эфира (-24 °С).
Прежде чем говорить о строении молекулы и о свойствах различных классов соединений, остановимся на строении атома с точки зрения квантово-механических представлений.
Как уже отмечалось, современная теория химической связи основана на квантово-механическом рассмотрении молекулы как системы из электронов и атомных ядер.
Из курса неорганической химии и физики известно, что электроны представляют собой вид материи, обладающий одновременно свойствами частицы и электромагнитной волны.
Согласно квантовой теории состояние электронов в атоме описывается с помошью четырех квантовых чисел; п – главное квантовое число, l – азимутальное квантовое число, т – магнитное квантовое число и s – спиновое квантовое число.
Электрон в атоме находится на определенной атомной орбитали. Атомная орбиталь – это область пространства внутри которой наиболее вероятно нахождение электрона,
Состояние электрона определяется расстоянием электронного облака от ядра, его формой, ориентацией в пространстве и вращением электрона вокруг собственной оси.
В зависимости от расстояния электрона от ядра атома изменяется траектория его движения, то есть форма атомной орбитали. Существуют s, p, d, f-атомные орбитали, которые отличаются друг от друга запасом энергии.
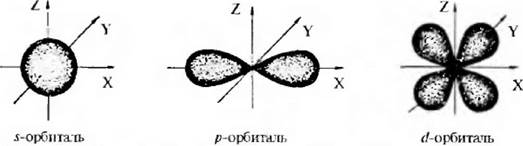
Pиc. 2. 1. Геометрическая форма s-, p- и d -орбиталей
Для атомных орбиталей j-типа характерна сферическая симметрия, XIя электронов р-типа существуют три одинаковых по энергии гантелеобразнон формы орбитали, которые отличаются друг от друга лишь ориентацией в пространстве: px, py, pz-атомные орбитали. В каждой из них существует узловая область p-эрбитали, где вероятность нахождения электрона равна нулю. Для атомных орбиталей существуют пять более сложных геометрических форм.
Электроны s-орбитали ближе находятся к атомному ядру и с большей силой притягиваются к нему, чем р-электроны, которые более удалены и имеют большую подвижность. Энергия электрона падает в следующем ряду:
f> d> p> s
Атомная орбиталь. не занятая электронам и, называется вакантной и условно обозначается как □.
|
|
