
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Взаимное влияние атомов в органических соединениях
|
|
Согласно современным представлениям, природа и механизм взаимного влияния атомов определяется характером распределения электронной плотности в молекуле и поляризуемостью ковалентных связей.
Электронные смешения в органических соединениях подразделяют на два вида: индуктивный эффект – смешение электронной плотности по цепи сьсвязей и мезомерный эффект – смещение по системе π -связей.
Индуктивный эффект. Рассматривая типы химических связей, мы отмечали, что между атомами с одинаковой электроотрицательностью пара электронов связи в равной мере принадлежит обоим участникам связи (ковалентная неполярная связь). Например, связи в молекулах метана, бутана – неполярные, электронная плотность в них распределена симметрично и молекула не имеет дипольного момента. Если же в молекуле бутана один атом водорода заместить на галоген – хлор, то электронная плотность ковалентной связи С-Сl смешается к более электроотрицательному атому хлора (ковалентная полярная связь):
Пара электронов а-связи принадлежит как углероду, так и хлору, но несколько смешена к хлору, поэтому хлор приобретает частично отрицательный заряд (δ -), а атом углерода связи С–Сl – равный по величине частично положительный заряд (δ +).
Уменьшение электронной плотности на С1 приводит к тому, что госледний, проявляя акцепторные свойства, смещает на себя электроны S-связи от соседнего атома углерода. Происходит поляризация связи С2–С1 и частичный положительный заряд возникает также на С2, что в свою очередь ведет к поляризации связи С2–C3 и возникновению частичного положительного заряда на С3 и т. д. При этом дробный положительный заряд на атомах углерода в цепи от С1 до С уменьшается: δ + > δ ’+ > δ ’’+ > δ ’’’+
Поляризация одной связи углерод-галоген вызывает поляризацию молекулы в целом и следовательно появлениедипольного момента.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Индуктивный (индукционный) эффект – передача электронного влияния заместителя вдоль цепи σ -связей, которая возникает в силу различной электроотрицательности атомов.
Индуктивный эффект обозначается буквой I, а смешение электронной плотности изображают с помошью стрелки вдоль простой σ -связи, острие которой указывает на направление смещения.
По направлению электронного влияния заместителей различают положительный +I и отрицательный –I индуктивный эффект.
Отрицательный индуктивный эффект проявляют заместители, притягивающие электроны о-связи, например: –NO3 –C≡ N, –СООН, –Hal, –ОН,

Отрицательный индуктивный эффект, как правило, увеличивается с ростом электроотрицательности атомов. Он сильнее выражен для заместителя с тройной связью, т. к. в его составе находится более электроотрицательный sр-гибридизованный атом углерода. В свою очередь атом углерода в sp3-гибридизации, как менее электроотрицательный, в составе заместителя проявляет + I по отношению к атомам углерода в sp и sр2-гибридизации:
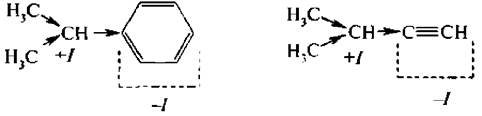
Положительный индуктивный эффект проявляют заместители, отталкивающие от себя электроны оσ -связи, чаше всего это алкильные группы (Alk). Электронодонорные свойства у алкильныч заместителей возрастают с ростом длины углеводородной цепи (–C4H9 > –СН3) и увеличиваются в ряду от первичных до третичных радикалов ((СН3)3С– > (CH3)2CH– > СН3СН2– > СH3–). Последнее объясняется тем, что индуктивный эффект затухает по цепи.
Суммируя вышеизложенное, кратко остановимся на основных свойствах индуктивного эффекта;
1. Индуктивный эффект проявляется лишь при наличии в молекуле атомов с различной электроотрицательностью.
2. Индуктивный эффект распространяется только через о-связи в одном направлении.
3. Индуктивный эффект быстро затухает по цепи. Максимум его действия – четыре σ -связи.
4. Индуктивное смещение определяется наличием дипольного момента: μ ≠ 0.
Мезомерный эффект (эффектсопряжения). Прежде чем рассматривать передачу электронного влияния заместителей по системе π -связей, определим понятия сопряженная система и сопряжение.
Сопряженной называется система, в которой имеет место чередование простых и кратных связей, либо соседство атома, имеющего вакантную р-орбиталь или неподеленную пару p-электронов. Сопряженные системы бывают с открытой и замкнутой цепью:
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
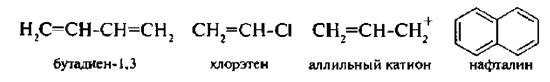
Каждая из приведенных цепей сопряженных связей называется еще цепью конъюгации (от латин. – перекрывание, наложение). В нихимеет место сопряжение – дополнительное перекрывание π - и p-орбиталей, имеющих параллельные оси симметрии (компланарные). За счет сопряжения происходит перераспределение (делокализация) π -электронной плотности и образование единой π -электронной системы.
От вида перекрываемых орбиталей различают несколько видов сопряжения: π, π -сопряжение (прекрывание двух π -орбиталей), p, π -сопряжение (перекрывание p- и π -орбиталей):

Рис. 2.9. Сопряженные системы бутадиена-1, 3, хлористого винила и аллильного катиона
Сопряжение – энергетически выгодный процесс, происходящий с выделением энергии. Сопряженные системы характеризуются повышенной термодинамической устойчивостью.
Дав определение сопряжению и сопряженным системам, рассмотрим электронные эффекты, которые наблюдаются при введении в такие системы различного рода заместителей.
Эффект сопряжения или мезомерный эффект (М) – процесс передачи электронного влияния заместителя по сопряженной системе π -связей. Смешение электронной плотности в сопряженных системах возможно лишь при включении в систему электронодонорных или электроноакцепторных заместителей.
Например, в молекуле бензола имеется сопряжение, но нет заместителей, поэтому мезомерный эффект отсутствует. Гидроксигруппа в молекуле фенола входит в сопряженную систему и проявляет мезомерный эффект, а в молекуле бензилового спирта –ОН группа изолирована от сопряженной системы двумя σ -связями и не проявляет мезомерного эффекта.
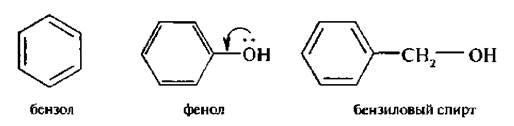
Мезомерный эффект обозначают буквой M, а смещение электронной плотности в сопряженной системе – изогнутой стрелкой. По направляющему действию заместителя мезомерный эффект делится на положительный (+М) и отрицательный (–М).
Положительный мезомерный эффект проявляют заместители (электронодонорные атомы или атомные группы), предоставляющих электроны в сопряженную систему, т. е. имеющие неподеленные пары электронов или отрицательный заряд:
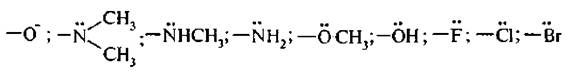
Максимальный +М у атомов с отрицательным зарядом. Заместители, содержащие неподеленные пары электронов, имеют тем больше +М, чем меньше в пределах периода электроотрицательность атомов, содержащих неподеленные пары электронов.
Отрицательный мезомерный эффект проявляют заместители, смещающие на себя электронную плотность сопряженной системы:

Максимальный –М проявляют заместители, несущие положительный заряд. В ненасыщенных группировках –М-эффект возрастает с увеличением разности электроотрицательности атомов кратной связи.
Рассмотрим несколько примеров проявления мезомерного эффекта:
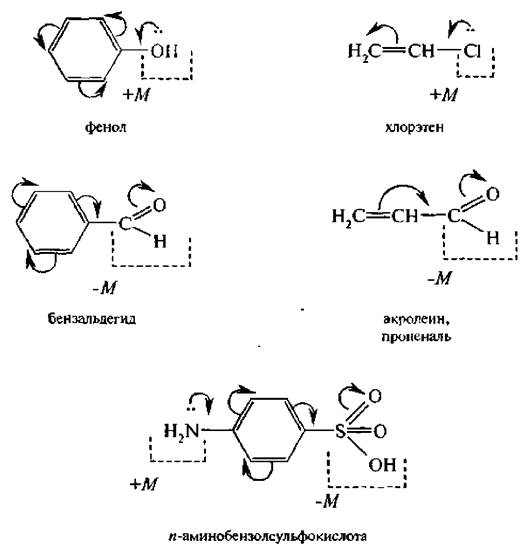
Мезомерный эффект по сравнению с индуктивным вызывает более сильное смещение электронной плотности и практически не затухает.
Совместное проявление индуктивного и мезомерного эффектов заместителя
Мезомерный и индуктивный эффекты одного заместителя могут совпадать и не совпадать по направлению. Например, в молекуле акролеина альдегидная группа  проявляет –I и –M, а гидроксильная группа в молекуле фенола обладает –I, но +M -эффектом,
проявляет –I и –M, а гидроксильная группа в молекуле фенола обладает –I, но +M -эффектом,
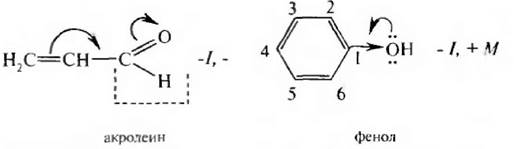
Как видно из приведенного примера, в молекуле фенола противоположное электронное смешение приводит к тому, что эти два эффекта как бы «гасят» друг друга. А в молекуле акролеина индуктивный и мезомерный эффекты усиливают друг друга. Мезомерный эффект заместителя обычно больше, чем индуктивный, так как л-связи поляризуются легче, чем σ -связи.
Поляризация, обусловленная мезомерным эффектом, имеет альтернирующий характер: под влиянием заместителя смешаются не только π -электронные облака, но и облака σ -связей. Это явление наблюдается в системах с открытой и замкнутой цепью сопряжения:
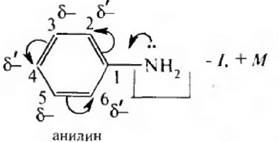
Хотя аминогруппа проявляет –I -эффект, вызывает понижение электронной плотности на всех атомах углерода ароматического цикла, но за счет +M -эффекта пары электронов атома азота, который больше –I в целом наблюдается повышение электронной плотности на атомах углерода бензольного кольца, особенно в положениях 2. 4. 6. Происходит альтернирующая поляризация.
В молекулах с открытой цепью сопряжения обычно указывают частичные заряды, которые сосредоточены на концах сопряженной системы:
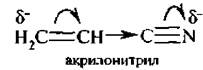
Эффект сверхсопряжения (гиперконъюгация). Наряду с π, π - и р, π -сопряжением имеет место особый вид сопряжения – гиперконъюгация (сверхсопряжение) или σ, π -сопряжение.
Эффект сверхсопряжения – взаимодействие, которое возникает при перекрывании электронного облака о-орбиталей связи С–Н с π -орбиталями кратной связи. Такой вид перекрывания электронных облаков представляет собой σ, π -сопряжение, которое присутствует как в алифатическом, так и в ароматическом ряду соединений. Смешение электронов при этом изображают с помощью изогнутой стрелки. Любая из σ -связей метильной группы пропена может участвовать в σ, π -сопряжении.
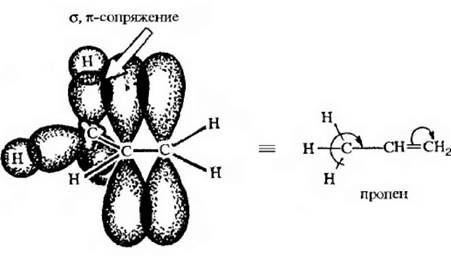
Рис. 2.10. Схема перекрывания σ -орбиталей связи С–Н с π -орбиталью кратной связи в молекуле пропена
Величина эффекта гиперконъюгации тем выше, чем больше атомов водорода при углероде, связанном с ненасыщенной системой. Понятие о сверхсопряжении объясняет повышенную реакционную способность, подвижность α -водороцных атомов в молекулах альдегидов, кетонов, кислот и их производных. Иногда сверхсопряжение называют по имени открывших его ученых эффектом Натана – Бекера.
ИЗОМЕРИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИИ. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ МОЛЕКУЛ
Термин изомерия (от греч. isos – одинаковый, meros – часть) впервые был введен в 1830 г., когда стали известны вещества, имеющие одинаковый качественный и количественный состав, но обладающие различными физическими и химическими свойствами.
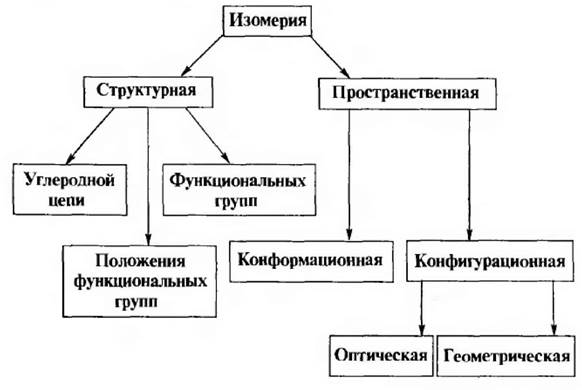
Изомерия – это явление, заключающееся в существовании соединений, имеющих одинаковую молекулярную формулу, но различающихся порядком связывания атомов в молекуле или расположением атомов в пространстве, и вследствие этого различающихся по физическим и химическим свойствам
Такие соединения называются изомерами. Различают два основных вида изомерии – структурную (изомерия строения) и пространственную (стереоизомерия).
|
|
