
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Тема 1.4 Вода. Растворы. Электролитическая диссоциация
|
|
Раствор – гомогенная система, состоящая из двух или более самостоятельных веществ и продуктов их взаимодействия. Вещество раздроблено до молекул или ионов размеров менее 1нм.
Растворы – это физико-химические системы, а не механические смеси частиц растворителя и растворенного вещества (Менделеев, 1887г)
Коэффициент растворимости – масса безводного вещества, растворяющегося при данных условиях в 100 г растворителя с образованием насыщенного раствора.
Насыщенный раствор – раствор, в котором растворяемое вещество при данной температуре не растворяется, так как находится в равновесии с избытком растворенного вещества.
Ненасыщенный раствор – раствор, в котором еще можно растворить добавочное количество растворенного вещества.
Концентрация раствора – численная величина, которая показывает содержание растворенного вещества в определенном количестве или объеме раствора.
Способы выражения концентрации растворов:
1. Массовая доля растворенного вещества – это отношение массы растворенного вещества к общей массе раствора.
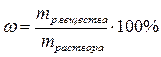
2. Молярная концентрация раствора вещества – отношение количества, растворенного вещества к объему этого раствора.
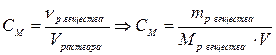
1М раствор – одномолярный раствор – 1 моль раствора вещества в 1 л раствора.
3. Нормальность – число эквивалентов вещества, растворенного в 1 л раствора.
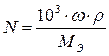
Согласно теории электролитической диссоциации С.Аррениуса (1887г.) при растворении в воде электролиты распадаются на свободные ионы.
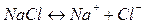
Проводниками электрического тока растворы веществ становятся, когда они содержат ионы, которые в электрическом поле приходят в направленное движение.
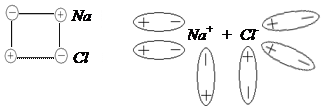
Электролитическая диссоциация – распад электролита на сольватированные (гидратированные) ионы под действием молекул растворителя.
AlCl3 → Al 3++ 3Cl-
a - степень электролитической диссоциации – отношение числа молекул электролита, распавшихся на ионы, к общему числу растворенных молекул.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
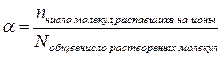
1) если a = 0, то вещество – неэлектролит (керосин, бензин, ацетон)
2) если a ≈ 1 или > 30 %, то вещество – сильный электролит (соли, неорганические кислоты, щелочи).
3) если a от 2 до 30 %, то вещество – средний электролит.
Слабыми электролитами являются органические кислоты, слабые неорганические кислоты, Н2О, некоторые основания, соли.
Реакциями ионного обмена (РИО)- реакции между ионами в водном растворе. Эти реакции протекают только в растворах и не сопровождаются изменением степеней окисления реагирующих веществ.
Правило Бертолле:
РИО протекает необратимо в случае, если:
1) образуется твердое труднорастворимое вещество - осадок (¯),
2) выделяется летучее вещество - газ (),
3) образуется малодиссоциирующее соединение (слабые электролиты, в том числе Н2О).
Пример оформления РИО:
Al2(SO4)3+3BaCl2 = 2AlCl3+3BaSO4¯ - молекулярная формула
Р р р н



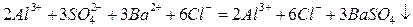 -полное ионное уравнение
-полное ионное уравнение
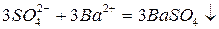 - сокращенное ионное уравнение.
- сокращенное ионное уравнение.
Десятичный логарифм концентрации ионов водорода, взятый с обратным знаком, называется водородным показателем.
рН = -lg[Н+] – водородной показатель
100 107 1014
 |
рН 0 7 14
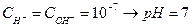 - среда нейтральная
- среда нейтральная
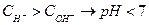 - среда кислая
- среда кислая

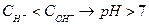 - среда щелочная.
- среда щелочная.
Задания для самоконтроля:
Задание № 1. Напишите уравнения электролитической диссоциации:
а) нитрата калия, б) хлорида кальция, в) сульфата натрия, г) йодоводорода, д) гидроксида калия, е) серной кислоты.
Задание № 2. Напишите в ионной форме уравнения реакций, представленных следующими схемами:
а) Ca(NO3)2+K2CO3→,
б) CaCO3+НNO3 →,
в) NaOH+ H2SO4→,
г) MgCO3 + H2SO4 →.
|
|
