
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Тема 1.6 Химические реакции
|
|
Химическая реакция – это процесс, в результате которого из одних веществ образуются другие, отличающиеся от них по составу и строению. Химические реакции можно классифицировать по следующим признакам.
1) По составу вещества
а) реакции, идущие с изменением состава вещества (реакции соединения, разложения, замещения, обмена)
б) реакции, протекающие без изменения состава вещества
С (графит) «С (алмаз)
3О2 (кислород) «2О3 (озон)
2) По изменению степени окисления химических элементов
а) реакции, идущие без изменения степени окисления
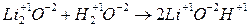
б) реакции, идущие с изменением степени окисления (ОВР)
2 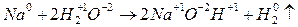
3) По агрегатному состоянию
а) гетерогенные – реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях
СаО(тв) + СО2(г) «СаСО3(тв)
б) гомогенные – реакции, в которых все вещества находятся в одном агрегатном состоянии
N2(г) + 3H2(г) «2NH3(г)
4) По участию катализатора
а) некаталитические реакции, идущие без участия катализатора
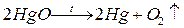
б) каталитические - реакции, которые идут с только участием катализатора.
5) По направлению
а) необратимые реакции протекают только в одном направлении до полного расходования одного из исходных веществ (¯, , Н2О)
б) обратимые реакции протекают как в прямом, так и в обратном направлении
6) По тепловому эффекту
а) экзотермические - реакции, которые протекают с выделением теплоты Q (+Q)
б) эндотермические - реакции, которые протекают с поглощением теплоты Q (- Q)
Тепловой эффект химической реакции – количество выделенной или поглощенной в результате химической реакции теплоты.
Реакция разложения – химическая реакция, при которой из одного вещества образуется 2 или несколько новых веществ.
Реакция соединения – химические реакции, при которых из двух или нескольких веществ получается одно сложное вещество.
Реакции замещения – химические реакции, при которых атомы, составляющие простое вещество, замещают атомы одного из элементов сложного вещества.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Реакция обмена – химические реакции, при которых молекулы двух сложных веществ обмениваются атомами или атомными группами.
Скорость химических реакций (V) определяется изменением концентрации прореагировавшего или образующегося вещества в единицу времени:
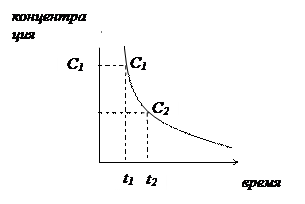
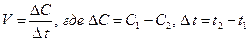
На скорость химических реакций влияют различные условия:
1) природа реагирующих веществ,
2) для вещества в растворенном состоянии и газов скорость химических реакций зависит от концентрации реагирующих веществ,
3) для веществ, находящихся в твердом состоянии, скорость реакции прямо пропорциональна поверхности реагирующих веществ.
Закон действующих масс (1867г., Гульдберг, Вааге) для гомогенных систем звучит так: при постоянной температуре скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ.
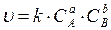 , где а, b – коэффициенты уравнения реакции, k – константа скорости, С – концентрации реагирующих веществ.
, где а, b – коэффициенты уравнения реакции, k – константа скорости, С – концентрации реагирующих веществ.
4) при повышении температуры на каждые 10°С скорость большинства реакций увеличивается в 2-4 раза (правило Вант – Гоффа).
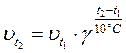 , где g - температурный коэффициент скорости, т.е. число, характеризующее ускорение реакции при нагревании на 10°С.
, где g - температурный коэффициент скорости, т.е. число, характеризующее ускорение реакции при нагревании на 10°С.
5) присутствие некоторых веществ. Вещества, которые ускоряют химические реакции, но сами при этом не расходуются, называют катализаторами.
Химическое равновесие – состояние системы, при котором скорость прямой реакции равна скорости обратной реакции.
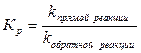 ,
,
где Кр – константа равновесия
k – константа скорости химической реакции
Если Кр = 1, 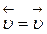 - химическое равновесие
- химическое равновесие
Если Кр > 1, 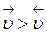 - продуктов реакции больше
- продуктов реакции больше
Если Кр < 1,  - продуктов реакции меньше.
- продуктов реакции меньше.
Правило смещения химического равновесия под влиянием внешних условий Ле Шателье (1884 г):
Если на систему, находящуюся в равновесии, оказывается внешнее воздействия (изменение С, р, t), то химическое равновесие смещается в ту сторону, которая ослабляет данное воздействие.
Следствия принципа смещения химического равновесия Ле Шателье:
1) при повышении концентрации (С) реагирующего вещества равновесие смещается в сторону образования продуктов реакции,
2) при повышении давления химическое равновесие смещается в сторону той реакции, при которой объем образующихся газов уменьшается,
3) при повышении температуры химическое равновесие смещается в сторону эндотермической реакции,
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
4) при понижении температуры химическое равновесие смещается в сторону экзотермического процесса.
Пример: определим, как сместится химическое равновесие в реакции N2+O2 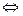 2NO-Q при повышении температуры.
2NO-Q при повышении температуры. 
Согласно принципу Ле Шателье при повышении температуры химическое равновесие смещается в сторону эндотермической реакции, т.е. в данном случае - в сторону прямой реакции.
Пример: определим, как сместится химическое равновесие в реакции N2+O2 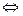 2NO-Q при понижении давления.
2NO-Q при понижении давления. 
При понижении температуры химическое равновесие смещается в сторону той реакции, при которой объем образующихся газов увеличивается.
Из уравнения видно, что объёмы газов в левой и правой части уравнения одинаковые, поэтому равновесие не смещается.
Катализ – изменение скорости реакций под действием катализатора.
Гомогенный катализ – катализатор находится в таком же агрегатном состоянии, как и реагирующие вещества.
Гетерогенный катализ – агрегатные состояния катализатора и реагента различаются.
Окислительно – восстановительными реакциями (ОВР) называют реакции, которые протекают с изменением степени окисления элементов.
Восстановитель – атом или ион, который отдает электроны и окисляется. Окислитель - атом или ион, который принимает электроны и восстанавливается.
Восстановление – процесс принятия электронов. Окисление – процесс отдачи электронов.
По распределению функций окислителя и восстановителя выделяют следующие типы ОВР:
1. Межмолекулярная ОВР – реакция, в которой функции окислителя и восстановителя выполняют разные реагирующие вещества.
2. Внутримолекулярная ОВР – реакция, в которой изменение степени окисления атомов происходит в одной и той же молекуле.
3. Реакция диспропорционирования – реакция, при которой окислительные и восстановительные функции выполняют атомы одного элемента в одной и той же степени окисления.
4. Реакция конмутации – реакция, в результате которой химический элемент, окисляясь и восстанавливаясь, приобретает одинаковую степень окисления.
Алгоритм расчета количества теплоты по термохимическим уравнениям реакции:
1) Записать условие задачи.
2) Записать термохимическое уравнение.
3) Подписать формулы веществ известных исходных данных.
4) Над подчеркнутой формулой указать исходные данные, под формулой числовые значения.
5) Рассчитать исходное количество теплоты в кДж.
6) Записать ответ.
Пример: Вычислить, какое количество теплоты выделится при сгорании 6, 2 г фосфора.
Термохимическое уравнение реакции:
4Р(тв) +5О2(газ)® 2Р2О5 (тв)+ 3010 кДж
Дано: Решение:

 т(Р)=6, 2 г 6, 2г Q
т(Р)=6, 2 г 6, 2г Q
Найти: 4Р + 5O2 ® 2Р2O5 + 3010кДж
Q-? 4× 31г\моль
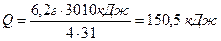
|
|
