
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Тема 1.3 Строение вещества
|
|
Химическая связь – взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы. Химическая связь может быть внутримолекулярной и межмолекулярной.
 |
Большое значение для формирования химической связи имеют:
1) длина связи - расстояние между взаимодействующими атомами,
2) энергия ионизации - энергия, которую необходимо затратить для отрыва электрона от атома,
3) электроотрицательность (ЭО)– способность атомов притягивать к себе электроны от других атомов. В периоде ЭО возрастает слева направо, а в группе ЭО понижается сверху вниз. Самой большой электроотрицательностью обладает фтор.
Ковалентная химическая связь(1916 г., Льюис) – связь, образующаяся между атомами за счет образования общих электронных пар, это двухэлектронная связь, принадлежащая одновременно ядрам двух атомов.
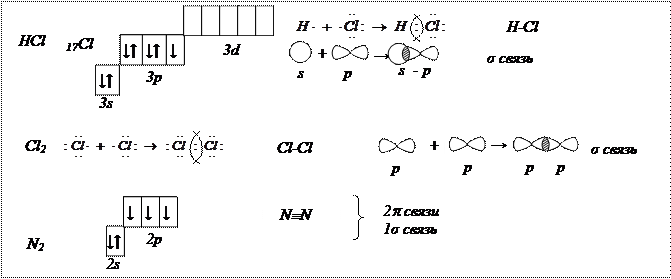
σ -связь – сигма - связь, при которой перекрывание электронных облаков происходит вдоль прямой, соединяющей центры взаимодействующих атомов. В молекуле азота (N2) общая электронная пара образуется за счет σ -связи, а 2 общие электронные пары за счет π -связи.
π -связь – пи – связь, боковое перекрывание двух р - орбиталей в двух областях с образованием двух максимумов электронной плотности по обе стороны от плоскости образования сигма - связи.
 |
Электроны, находящиеся на внешнем энергетическом уровне атома которые могут принимать участие в образовании химических связей, называются валентными.
Валентность определяется: числом неспаренных электронов, наличием свободных орбиталей и неподеленных электронных пар.
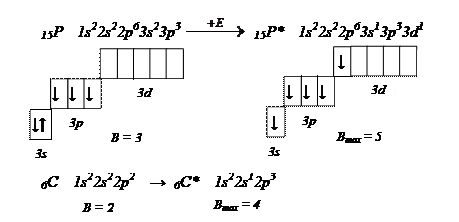
Для определения валентных возможностей атома рассматривают распределение электронов по энергетическим уровням и подуровням для невозбужденных и возбужденных состояний атома.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
 |
Неполярная ковалентная связь – связь, образующаяся между атомами неметаллов с одинаковой электроотрицательностью (в молекулах простых веществ).
Полярная ковалентная связь – связь между атомами неметаллов, электроотрицательность которых не сильно различается, при этом происходит смещение общей электронной пары к наиболее электроотрицательному атому (между атомами различных неметаллов).
Ионная химическая связь – связь, образовавшаяся за счет электростатического притяжения катионов к анионам. Она образуется между ионами металлов и неметаллов, электроотрицательность которых сильно отличается друг от друга.
Металлическая химическая связь– связь в металлах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке. Она основана на обобществлении валентных электронов, принадлежащих всем атомам в кристалле.
Водородной связью называют химическую связь, образованную атомом водорода, связанным с атомом другого более электроотрицательного элемента (О, F, N, Сl). Эта связь обусловлена электростатическим притяжением, которому способствуют малые размеры атома водорода. Водородная связь может быть межмолекулярной и внутримолекулярной.
Степень окисления – это условный заряд атома в молекуле, вычисленный согласно предположению о том, что молекула состоит только из ионов. Правила нахождения степени окисления следующие:
1) Алгебраическая сумма степеней окисления атомов в молекуле любого вещества равна нулю,
2) Степень окисления элемента в простом веществе равна нулю,
3) Степень окисления атомов в молекуле сложного вещества может быть выражена отрицательным или положительным числом,
4) Алгебраическая сумма степеней окисления атомов в сложном ионе равна его заряду,
5) Элементы с постоянной степенью окисления: Н +1(кроме гидридов), О –2 (кроме пероксидов) и ОF2 , элементы главной подгруппы 1 группы +1, все элементы 2 группы, кроме Hg +2, алюминий АI +3, фтор F – 1.
Кристаллические решётки могут быть атомными, молекулярными, ионными, металлическими. Ионные кристаллические решетки встречаются у большинства солей, щелочей и некоторых оксидов типичных металлов.
Атомные кристаллические решётки имеют углерод в форме алмаза, кремний, германий, бор.
Молекулярные решётки встречаются у большинства неорганических веществ Н2О (тв), НCl (тв), Н2S (тв) и неметаллов (Н2, N2 (тв), О2 (тв), Cl2 (тв), Р4, S8.
Схему образования ионной связи в NaCl можно представить:
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Na +  → Na+[:
→ Na+[:  ]-
]-
Образование ковалентной неполярной химической связи в молекуле хлора (Сl2): 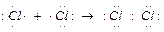
Задания для самоконтроля:
Задание № 1. Составьте структурные и электронные формулы соединений с водородом следующих элементов:
а) кремния, б) фосфора, в) брома, г) углерода.
Задание № 2. Определите степени окисления элементов в следующих веществах:
а) MgCl2, б) Na2SO4, в) KHSO4, г) NH3, д) KNO2, е) Na2Cr2O7, ж) NaSbO3, з) KMnO4.
Задание № 3. Составьте структурные и электронные формулы следующих веществ:
а) MgCl2, б) Н2S, в) F2, г) NH3, д) O2, е) CO2 .
Определите виды химической связи в данных соединениях.
|
|
