
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Тема 1.7 Металлы и неметаллы
|
|
Металлы – это химические элементы, атомы которых отдают электроны внешнего (некоторые – и предвнешнего) электронного слоя, превращаясь в положительные ионы – катионы.
Li K Ba Ca Na Mg Al Mn Zn Cr Fe Co Sn Pb H Cu Hg Ag Au
Металлы, стоящие в ряду активности до водорода, вытесняют его из растворов многих кислот, а все следующие за ним - не вытесняют. Исключение составляют концентрированная серная и азотная кислоты, которые реагируют с большинством металлов, но водорода при этом никогда не выделяется.
В металлургии железо и его сплавы выделяют в одну группу под названием черные металлы, а все остальные металлы имеют техническое название - цветные.
Сталь – это сплав на основе железа, содержащий менее 2 % углерода. По химическому составу стали разделяют на углеродистую и легированную.
Чугун – это сплав на основе железа, содержащий от 2 до 4, 5 % углерода, а также марганец, кремний, фосфор и серу. Металлы легко отдают валентные электроны, т.е. обладают восстановительными свойствами. Восстановительная способность – мера их химической активности.
Химические свойства металлов:
1) Металлы реагируют с простыми веществами:
а) с галогенами (элементы VII группы)
2Na+J2 ® 2NaJ – йодид натрия
б) с элементами VI группы
2Mg+O2 ® 2MgO – оксид магния
Ca+S ® CaS – сульфид кальция
в) с элементами V группы
3Ca+2P ® 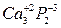 - фосфид кальция
- фосфид кальция
3Ca+N2 ® 3 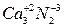 - нитрид кальция
- нитрид кальция
г) с элементами IV группы
Са+2С ® СаС2 – карбид кальция
д) щелочные и щелочно-земельные металлы реагируют с водородом
2Na+H2 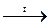 2NaH – гидрид натрия.
2NaH – гидрид натрия.
2) металлы реагируют со сложными веществами:
а) металлы вытесняют Н из разбавленных кислот (кроме HNO3)
Ba+2HCl ® BaCl2 + H2
разб.
Fe + H2SO4 ® FeSO4 + H2
разб.
 Cu+HCl ®
Cu+HCl ®
б) с водой (с образованием гидроксидов)
2Na+2H2O ® 2NaOH+H2 (при обычной температуре только щелочные и щелочно-земельные металлы)
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Zn+H2O  ZnO+ H2
ZnO+ H2
в) с солями
Fe+CuSO4 ® FeSО4+Cu¯
Zn+Pb(NO3)2 ® Pb¯ +Zn(NO3)2.
Неметаллы – это химические элементы для атомов, которых характерна способность принимать электроны до завершения внешнего энергетического уровня, так как на внешнем электронном слое от 4 до 8 ē, малый радиус атомов в сравнении с атомами металлов.
Всего известно 22 неметалла (в том числе инертные газы).
Исключение: элементы 8 главной группы – инертные газы. Они относятся к неметаллам по физическим свойствам. Их инертность относительна: 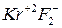 ,
, 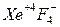 .
.
Неметаллы обладают высокими значениями ЭО.
Положение неметаллов в Периодической системе (ПСХЭ)
1 2 3 4 5 6 7 8 группа
 1 Н Не
1 Н Не
 |
 2 В С N O F Ne
2 В С N O F Ne
3 Si P S Cl Ar
4 As Se Br Kr
5 Te J Xe
неметаллы -
6 p элементы At Rn
кроме: Н, Не – S-элементы
Неметаллы – это химические элементы, которые образуют в свободном состоянии простые вещества, не обладающие физическими и химическими свойствам металлов.
В кристаллической решетке неметаллов, как правило, нет свободных электронов. В связи с этим твердые вещества - неметаллы в отличие от металлов плохо проводят тепло и электричество, не обладают пластичностью.
Неметаллы (простые вещества)
 | |||
 |
с немолекулярным строением с молекулярным строением
 (атомным)
(атомным)
С, В, Si, P, Se Cl2, F2, О2, H2, N2 – газы
 Br2 – жидкость
Br2 – жидкость
J2, P4, S8 – тв. вещества
атомная кристаллическая молекулярная кристаллическая
 решетка (в узлах решетки - атомы) решетка (в узлах - молекулы)
решетка (в узлах решетки - атомы) решетка (в узлах - молекулы)
 |
 Физические свойства
Физические свойства
 |
твердые вещества, низкие температуры плавления,
высокие температуры высокая летучесть
плавления
Цвет неметаллов: Рам – красный, O2 – голубой, Вам – коричневый, Si – серый, Cl2 (г) – желто-зеленый, Br2 (ж) – бурый, J2 (т) – фиолетовый, S8 – желтый.
Ряд электроотрицательности неметаллов:
H, Si, As, P, Se, C, S, I, Br, Cl, N, O, F.
Химические свойства неметаллов:
1) Взаимодействие неметаллов с простыми веществами

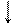

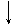

 -2e +2e
-2e +2e
1) S + Cl2 ® 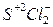 1) S0 + H2 ®
1) S0 + H2 ® 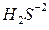
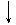


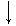

 с галогенами с водородом
с галогенами с водородом
-4e +2e
2) S + O2 ® 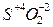 2) S0 + Ca0 ®
2) S0 + Ca0 ® 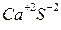
с кислородом с Ме
 |
Неметаллы могут проявлять как окислительные, так и восстановительные свойства.
2) Взаимодействие со сложными веществами:
1) Cl2 + CO ® COCl2
2) C + 2CuO ® CO2 + 2Cu¯
3) Cl2 + 2NaJ ® 2NaCl + J2
4) 2F2 + 2H2O ® 2HF + O2
5) 4NH3 + 5O2 ® 4NO + 6H2O
Окислительные свойства неметаллов проявляются при взаимодействии с металлами 4Al + 3C = Al4C3
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Неметаллы играют роль окислителя при взаимодействии с водородом
H2 + F2 = 2HF
Окислительные свойства проявляются в реакциях с некоторыми сложными веществами CH4 + 2O2 = CO2 + 2H2O
Многие неметаллы выступают в роли восстановителей в реакциях со сложными веществами-окислителями S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
Наиболее сильные восстановительные свойства имеют углерод и водород ZnO + C = Zn + CO.
Задания для самоконтроля:
Задание № 1. Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения:
а) MnO2→ MnCl2→ Mn→ MnSO4→ Mn(OH)2,
б) Cu(OH)2→ CuO→ Cu(NO3)2→ CuS,
↓
Cu(OH)2
в) Ni→ NiSO4→ Ni(NO3)2→ Ni(OH)2,
↓
Ni
Задание № 2.Составьте уравнение ОВР с участием галогенов:
а) ____ + Br2 → PBr3,
б) Al + J2 → ____,
в) H2 + Br2 → ____,
г) NaJ + Br2 → ____,
д) MgBr2 + Cl2 → ____.
Укажите окислитель и восстановитель.
Задание № 3.Напишите уравнения реакций, с помощью которых можно осуществить цепь следующих превращений:
а) N2 → NH3 → NO → NO2 → HNO3 → NaNO3,
б) P → P2O5 → H3PO4 → Na3PO4 → Ca3(PO4)2,
в) С → CO → CO2 → K2CO3 → CaCO3 → CO2,
г) Si → SiO2 → Na2SiO3 → H2SiO3.
↓
Si → Mg2Si
|
|
