
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ДНК-полимераза III E. coli
|
|
Главной репликативной ДНК-полимеразой E. coli является многосубъединичный комплекс ДНК-полимеразы III (PolIII). Самая большая каталитическая a-субъединица PolIII длиной 1160 остатков кодируется существенным геном dnaE и содержится в клетках в ограниченном количестве (10-20 копий на клетку).
Большую часть молекулы белка DnaE (рис. 1-8) занимает полимеразный домен, относящийся к особому бактериальному семейству С ДНК-полимераз. Белок DnaE содержит на самом С-конце (остатки 1000-1073) короткий домен связывания с нуклеиновыми кислотами, имеющий укладку типа ОВ. Семейство белковых доменов ОВ включает домены связывания с антикодоном тРНК некоторых аминоацил-тРНК-синтетаз, домен геликазы RecG, участвующей в репарации ДНК, и домены связывающих онДНК белков SSB бактерий и RF-A эукариотов (см. 2.2).
N-концевая область DnaE (остатки 1-210) состоит из N- и С-доменов (остатки 1-70 и 80-210 соответственно), гомологичных доменам РНР семейства фосфоэстераз – ферментов, гидролизующих фосфоэфирные связи по механизму, зависящему от катионов металлов. Фосфоэстеразная (фосфатазная) активность DnaE потенциально могла бы участвовать в гидролизе пирофосфата – продукта реакции синтеза ДНК. Удаление пирофосфата должно препятствовать обратной реакции пирофосфоролиза ДНК и сдвигать равновесие реакции, катализируемой ДНК-полимеразами, в сторону полимеризации. Однако у большинства известных бактериальных ДНК-полимераз фосфоэстеразный активный центр доменов РНР разрушен заменами аминокислотных остатков, делециями или вставками. Поэтому домены РНР не обладают фосфатазной или 5’-нуклеазной активностью. Сохранение таких мотивов не только у бактериальных ДНК-полимераз III, но и у ДНК-полимераз эукариотов и археев позволило предположить, что они играют существенную роль. И действительно, делеция N-концевых 60 остатков белка DnaE существенно понижает активность PolIII. Высказано предположение, что древние каталитически неактивные фосфоэстеразные домены РНР могут связывать пирофосфат и аллостерически регулировать активность PolIII.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
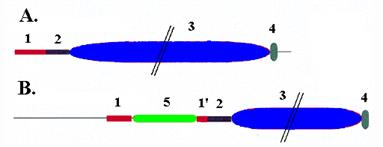
Рис. 1.8. Домены больших субъединиц бактериальных ДНК-полимераз III. A – ДНК-полимеразы DnaE E. coli и Bac. subtilis, B – ДНК-полимераза PolC Bac. subtilis.
1 и 2 – N- и С-концевая часть фосфоэстеразного домена, 3 – ДНК-полимеразный домен, 4 – С-концевой домен с укладкой РНР для связывания с ДНК. У ДНК-полимеразы PolC N-концевая часть фосфоэстеразного домена разорвана вставкой (3’®5’)-экзонуклеазного домена 5
a-Субъединица ДНК-полимеразы E. coli не имеет ни 5’-экзонуклеазного, ни (3’®5’)-экзонуклеазного доменов. Тем не менее, PolIII проявляет высокую точность синтеза ДНК и обладает корректорской (3’®5’)-экзонуклеазной активностью. Она обусловлена другой, e-субъединицей – белком длиной 243 остатка, который кодируется геном dnaQ и содержит 6 областей гомологии с (3’®5’)-экзонуклеазными доменами других ДНК-полимераз. Для экзонуклеазной активности существенны 3 первых первые области гомологии в N-концевой части белка DnaQ. Его N-концевой фрагмент длиной 186 остатков проявляет полную экзонуклеазную активность, но не взаимодействует с a-субъединицей PolIII. Для такого связывания необходим С-концевой домен e-субъединицы длиной 57 остатков. Физическая нековалентная ассоциация субъединиц a и e абсолютно необходима для корректорской функции всего комплекса ДНК-полимеразы III. Субъединицы a и e, вместе с самой маленькой субъединицей q, кодируемой геном holE, образуют минимальный фермент, или сердцевину, ДНК-полимеразы III E. coli. В этой сердцевине, обозначаемой как PolIII’, нем e-субъединица взаимодействует с субъединицами a и q, причем во взаимодействии с q участвует N-концевой домен e. Биохимические функции субъединицы q в минимальном ферменте PolIII пока не установлены.
Грамположительные бактерии с низким содержанием ГЦ в ДНК (например, сенная палочка Bacillus subtilis) имеют не одну, а две ДНК-полимеразы III семейства С. Одна из них наиболее гомологична a-субъединицы субъединице PolIII E. coli и названа DnaE. Она также не имеет (3’®5’)-экзонуклеазного домена. Однако в геноме Bac. subtilis не найден гомолог гена dnaQ E. coli. Пока не ясно, как обеспечивается корректорская функция этой ДНК-полимеразы. Возможно, для этого используется какая-то (3’®5’)-экзонуклеаза, не гомологичная белку DnaQ E. coli. Вторая репликативная ДНК-полимераза у Bac. subtilis, кодируемая геном polC, названа PolC. Белок PolC содержит гомологичный белку DnaQ (3’®5’)-экзонуклеазный домен, встроенный в N-мотив РНР (рис. 1.8), и сама обладает корректорской экзонуклеазной активностью. Можно предположить, что общий предок бактериальных ДНК-полимераз семейства С, подобно ДНК-полимеразам семейства В, имел (3’®5’)-экзонуклеазный домен, ковалентно связанный с полимеразным доменом. Этот корректорский домен остался перманентно ассоциированным с полимеразным доменом у ДНК-полимераз PolC грамположительных бактерий и обособился в самостоятельную субъединицу DnaQ у ДНК-полимераз DnaE грамотрицательных бактерий.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Наиболее сложным ансамблем ДНК-полимеразы III E. coli, участвующим в репликации хромосомы, является холофермент PolIII, состоящий из 10 разных субъединиц (a, b, g, d, d’, e, t, q, c и y), кодируемых 9 генами (табл. 1.2). Из клеток E. coli были выделены три разных полимеразных субкомплекса: 1) минимальный фермент aeq; 2) ансамбль III’, содержащий два сердцевинных субкомплекса, прикрепленных к димеру субъединицы t (a2e2q2t2); 3) субкомплекс III*, состоящий из 9 разных субъединиц (a2e2q2t2). Субкомплекс III* отличается от полного холофермента только отсутствием 4 субъединиц b. Общая организация холофермента PolIII представлена на рис. 1.9.
Субкомплексы PolIII синтезируют ДНК с низкой скоростью (10-20 н./сек) и степенью процессивности, равной 10-50. b-Субъединица, кодируемая геном dnaN, является вспомогательным фактором (скользящим зажимом PolIII), обеспечивающим более высокую скорость синтеза (750 н./сек) и процессивность. Включение b-субъединицы в холофермент осуществляется погрузчиком скользящего зажима - g-комплексом g2d1d’1y1c1. Функции b-субъединицы и g-комплекса будут рассмотрены отдельно (см. 1.4). Пока ограничимся только функциями субъединицы t, играющей роль платформы для сборки и поддержания общей структуры холофермента PolIII.
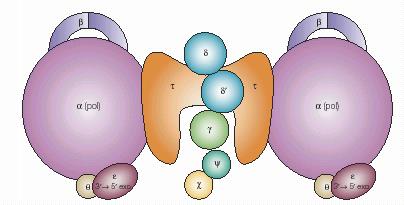
Рис. 1.9. Общая схема организации холофермента ДНК-полимеразы III E.coli
Субъединицы t и g («белки DnaX») кодируются одним и тем же геном dnaX и являются альтернативными продуктами трансляции его мРНК. Полноразмерным продуктом трансляции является субъединица t длиной 643 аминокислотных остатка. Во внутренней области мРНК dnaX имеется сайт трансляционного сдвига рамки – «скользкая» последовательность из 6 смежных остатков A, за которой расположена стабильная шпилечная структура (рис. 1.10). На таком сайте рибосомы часто (с вероятностью 10-20%) проскальзывают во время трансляции на один кодон назад, в 5’-сторону и продолжают трансляцию в новой открытой рамке считывания -1. В мРНК dnaX в этой альтернативной рамке они декодируют только один кодон GAG глутаминовой кислоты, а затем попадают на стоп-кодон UAG, на котором трансляция терминируется. Продуктом такого рибосомного сдвига рамки является белок g длиной всего 431 остаток. За исключением С-концевого остатка глу, он идентичен N- концевым 2/3 субъединицы t.
|
|
|

Рис. 1.10. Трансляционный сдвиг рамки считывания при трансляции мРНК гена dnaX E. coli
Указано положение скользкой последовательности AAAAAA и начала стабильной шпильки мРНК. *** - терминация трансляции на кодоне UGA в рамке считывания -1
|


Рис. 1.1011. Доменная организация субъединиц t (А) и g (В) холофермента ДНК полимеразы III E.coli.
Указаны области субъединицы t, участвующие в связывании субъединицы a, dd’ и yc холофермента ДНК-полимеразы III и ДНК-геликазы репликативной вилки DnaB, а также область субъединицы g для связывания комплексов dd’ и cy и белка скользящего зажима DnaB. RFC – участки гомологии с субъединицами эукариотического фактора RFC
Ограниченный протеолиз полноразмерного продукта гена dnaX позволил разбить его на 5 доменов (рис. 1.11). Первые три домена являются общими для субъединиц t и g. N-концевая область 1 образует АТФазный домен, функции которого мы рассмотрим при анализе работы комплекса скользящего зажима (см. 1.4). Общая центральная область 3 содержит участки взаимодействия, необходимые для образования димера субъединиц t и для связывания с ним g-субъединицы. С этой областью в белке g ассоциируются остальные субъединицы комплекса погрузчика. Белки d и c прямо связываются с g. В свою очередь субъединицы d и y образуют субкомплексы со стехиометрией 1: 1 с субъединицами d’ и c соответственно и служат мостиками между d’ и c и белком g. Связывание субкомплекса cy повышает сродство g к субкомплексу dd’.
Два последних домена (4 и 5) целиком имеются только у белка t. С-концевой домен 5 длиной 147 остатков играет наиболее важную роль в образовании димерной ДНК-полимеразы III. В димере t2 каждая из субъединиц t связывает по одной субъединице a сердцевины PolIII. Такое взаимодействие обеспечивает ассоциацию двух ДНК-полимераз, одна из которых участвует в синтезе ведущей, а вторая – в синтезе отстающей нити ДНК в реплисоме. Домен 4 состоит из короткой N-концевой части, имеющейся у белков t и g, и уникальной С-концевой части длиной 66 остатков, имеющейся только у белка t. Именно с этой уникальной областью и связывается ДНК-геликаза репликативной вилки – белок DnaB (см. 2.1). Во взаимодействии ДНК-полимеразы III с гексамерным белком DnaB участвуют обе субъединицы димера t2. Это обеспечивает дополнительную связь между ДНК-полимеразами ведущей и отстающей нитей, важную для динамики репликативного комплекса.
|
|
