
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ДНК-полимеразы d и e
|
|
Гетеромультимерные ДНК-полимеразы g и e (Polg и Pole) участвуют не только в репликации ДНК, но и в нуклеотидной эксцизионной репарации, эксцизионной репарации оснований, коррекции ошибочно спаренных оснований, репарации двунитевых разрывов ДНК и рекомбинации и являются наиболее самыми важными из эукариотических ДНК-полимераз. Они относятся к полимеразному семейству В. Самая большая субъединица (А) Pold наиболее консервативна среди эукариотических ДНК-полимераз этого семейства: у человека и дрожжей она идентична на 49%, а у человека и мыши – на 98%. В то же время идентичность больших А-субъединиц Pole у человека и мыши составляет всего 39%.
|
|
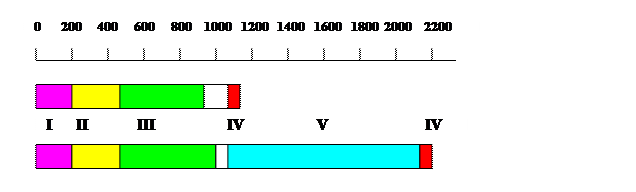
Рис. 1.14. Схема доменной организации больших субъединиц эукариотических ДНК-полимераз d (А) и e (В).
I – N-концевой домен, II - (3’®5’)-экзонуклеазный домен, III – полимеразный домен, IV – домен цинковых пальцев, V – уникальный С-концевой домен ДНК-полимераз e
Большая субъединица Pold, имеющая длину ~ 1100 остатков у дрожжей S. cerevisiae, cостоит из 4 доменов (рис. 1.14, А). N-концевой домен (остатки 1-200) наименее консервативен и содержит сигнал ядерной локализации NLS. Этот домен может участвовать во взаимодействиях с циклин-зависимыми протеинкиназами и ядерным антигеном пролиферирующих клеток PCNA. Более консервативен С-концевой домен (остатки 850-1110), содержащий три почти идентичных блока и домен цинкового пальца, на 98% совпадающий у Pold дрожжей и человека. Между этими доменами расположены основные каталитические области: (3’®5’)-экзонуклеазный домен (остатки 200-430) и ДНК-полимеразный домен (остатки 450-850) с такими же консервативными мотивами А и С активного центра, как у ДНК-полимеразы a.
Большая субъединица ДНК-полимеразы e у S. cerevisiae имеет длину 2222 остатка, т.е. вдвое длиннее большой субъединицы Pold. В N-концевой половине, в которой расположены (3’®5’)-экзонуклеазный и полимеразный домены, эти различия не столь заметны. Правда, в полимеразном домене Pole последовательности консервативных мотивов А (EL D T D G) и С (D xxAMYPN) изменены по сравнению с ДНК-полимеразами a и g, но триада кислых остатков асп каталитического центра сохранилась. Главная особенность ДНК-полимераз e состоит в существовании огромного С-концевого домена длиной около 1000 остатков, имеющегося только у Pole. На С-конце большой субъединицы Pole расположены очень кислая область и консервативный домен цинкового пальца (остатки 2100-2200), состоящий из двух связывающих Zn2+ модулей типа С4 (ZF1 и ZF2), разделенных спейсером. C-концевой домен Pole используется для белок-белковых взаимодействий, существенных для физиологических функции ДНК-полимеразы e.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
ДНК-полимераза d считается главным ферментом, ответственным за элонгацию по время репликации эукариотической ДНК. Этот вывод основан на генетическом и биохимическом анализе частично дефектных по Pold мутантов почкующихся и делящихся дрожжей и особенно на реконструкции in vitro репликации минихромосом вируса SV40. В этой вирусной системе для репликации требуются две клеточных ДНК-полимеразы. ДНК-полимераза a и ассоциированная с ней праймаза синтезируют затравки РНК-ДНК для инициации синтеза ведущей нити и каждого из фрагментов Оказаки в отстающей нити. Последующую элонгацию ведущей нити и завершение фрагментов Оказаки в отстающей нити (см. гл. 4) катализирует Pold, которая не требует помощи Pole. Более того, в опытах in vivo установлено, что с реплицирующейся ДНК вируса SV40 сшиваются ДНК-полимеразы a и d, но не Pole. Таким образом, в частном случае репликации вирусной ДНК роль ДНК-полимеразы e не обнаруживается.
Тем не менее, Pole явно имеет отношение к репликации хромосомной ДНК эукариотических клеток. Антитела к Pole человека ингибируют репликацию хромосомной ДНК в человеческих фибробластах, а в клетках почек обезьяны Pole сшивается с вновь синтезированной хромосомной ДНК. Нокаут гена POL2, кодирующего большую субъединицу Pol2 ДНК-полимеразы e у S. cerevisiae, летален и вызывает дефект по репликации ДНК. Однако комплементацию этого дефекта вызывает не полимеразный домен, а изолированный С-конце вой домен белка Pol2 с мол. массой 120 кД. Вместе с тем, даже точечные мутации или маленькие делеции, затрагивающие домены цинковых пальцев на самом С-конце этого белка, вызывают дефект по репликации хромосом и по контрольной точке S/M клеточного цикла, предотвращающей сегрегацию нереплицированных или поврежденных хромосом. Поэтому высказывается предположение, что незаменимой областью большой субъединицы Pole является не полимеразный, а уникальный и консервативный у всех эукариотов С-концевой домен, участвующий в регуляторных событиях клеточного цикла. Тем не менее, в отличие от полной делеции полимеразного домена Pole, точечные мутации в этом домене летальны для дрожжей. Эти данные позволяют предположить, что функцию Pole в синтезе ДНК могут заменить другие ДНК-полимеразы, например Pold, но они не заменяют регуляторную функцию уникальной С-концевой половины. Точечные мутации в полимеразном домене могут препятствовать такой замене синтетической функции Pole или же оттитровывают какие-то клеточные факторы, существенные для репликации. Истинная роль Pole в репликации пока остается невыясненной. Возможно, ДНК-полимераза e участвует в поздних стадиях синтеза отстающей нити или же реплицирует клеточные хромосомы только в самом конце фазы S клеточного цикла.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
ДНК-полимеразы d и e являются гетеромультимерными комплексами, в состав которых входят не только большие субъединицы А, но и несколько вспомогательных субъединиц меньшего размера. Их число равно 2 у S. cerevisiae, 3 у человека и 4 у делящихся дрожжей Schizosaccharomyces pombe в случае Pold и 3 в случае Pole у всех этих видов (табл. 1.3). Гомология малых субъединиц между разными видами гораздо меньше (20-25%), чем гомология больших субъединиц, а функции вспомогательных белков изучены еще недостаточно. Эти дополнительные субъединицы могут участвовать, например, в сборке и/или поддержании стабильности целых репликазных ансамблей.
У ДНК-полимеразы d S. cerevisiae вспомогательные субъединицы р58 и р55, похожие на субъединицы р50 и р66 человека, кодируются соответственно существенным геном POL31 и несущественным геном POL32. Мутант с нокаутированным геном POL32 жизнеспособен, но холодочувствителен по репликации и про вляет повышенную чувствительность к агентам, повреждающим ДНК. Продукт этого гена связывает ядерный антиген пролиферирующих клеток PCNA. Белки р55 и р58, экспрессированные порознь, находятся в димерной форме, а при одновременной экспрессии образуют гетеротетрамер (р55-р58)2. При коэкспрессии р55 с большой субъединицей р125 образуется их гетеродимер. В клетках дрожжей дикого типа обнаружена наиболее высокомолекулярная форма ДНК-полимеразы d - (р125-р58-р55)2 с мол. массой ~500 кД, являющаяся димером гетеротримера всех 3 субъединиц. При реконструкции Pold человека из субъединиц р125, р50, р66 и р12, экспрессированных рекомбинантными бакуловирусами в клетках насекомых, обнаружены 3-субъединичный (р125-р66-р50) и 4-субъединичный (р125-р66-р50-р12) субкомплексы, причем ДНК-полимеразная активность у последнего в 15 раз выше, чем у первого. Это показало, что для оптимальной полимеразной активности Pold требуется даже самая маленькая субъединица р12, отсутствующая у почкующихся дрожжей. Вероятно, активной формой ДНК-полимеразы d человека является димер 4-субъединичного субкомплекса.
ДНК-полимераза e дрожжей состоит из субъединиц р256, р80, р23 и р22. При коэкспрессии этих рекомбинантных субъединиц в различных сочетания обнаружены гетеродимерные субкомплексы р256-р80 и р23-р22, которые ассоциируются друг с другом с образованием гетеротетрамера. Субъединица р80 сама способна образовывать гомодимер, а гетеродимер р256-р80 димеризуется с образованием гетеротетрамера (р256-р80)2. За димеризацию гетеродимера отвечает субъединица р80, для взаимодействия с которой необходима и достаточна С-концевая половина р256, включая домен цинковых пальцев. У Pole человека две самые маленькие субъединицы (р17 и р12) также взаимодействуют с двумя самыми большими субъединицами (р261 и р59) и образуют гетеротетрамерный комплекс.
По-видимому, общим свойством эукариотических ДНК-полимераз d и e является образование комплексов, в которые входят две молекулы самой большой субъединицы, ответственной за полимеразную активность, как и в случае бактериальной ДНК-полимеразы III. Продолжая эту аналогию с бактериальными репликазами, можно ввести понятие холоферментов Pold и Pole, в состав которых, помимо главной полимеразной субъединицы и вспомогательных белков, входят скользящий зажим (белок PCNA) и его погрузчик (пентамерный белок RF-C). В присутствии белка PCNA процессивность ДНК-полимеразы d увеличивается с 1200 до 3500, а при анализе стационарной кинетики синтеза ДНК – с 100 до нескольких тысяч. PCNA облегчает образование комплекса Pold-ДНК и уменьшает константу скорости диссоциации этого комплекса. ДНК-полимераза e проявляет достаточно высокую процессивность при низкой ионной силе и в отсутствие PCNA, но в физиологических условиях (в присутствии 0, 15 М NaCl) становится непроцессивной, и тогда PCNA способствует восстановлению высокой процессивности.
|
|
