
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Фотохимические реакции. Законы фотохимии
|
|
Это реакции, которые протекают под действием света или реакции, энергия для протекания которых подводится в реакционную систему в форме электромагнитных колебаний (видимый свет, УФ-излучение и реже ИК-лучи). Фотохимические реакции: реакции синтеза, разложения, окисления, изомеризации, полимеризации и другие. Все фотохимические реакции протекают в две стадии:
1. Первичные реакции - протекают непосредственно под действием света (возникновение активных частиц). К этим процессам относятся:
а) диссоциация молекул на атомы или радикалы (фотолиз)
АВ + hν → А ˙ + В ˙, пример: Cl2 + hν = 2Cl ˙;
б) возбуждение молекул или атомов с образованием активной частицы (энергии кванта не хватает для диссоциации молекул)
М + hν → М *, где hν - световой квант, М * - возбужденная молекула;
в) ионизация молекул или атомов с выделением электрона (фотоэффект)
М + hν → М+ + ē,
Пример - эмульсия AgBr в желатине (при фотографировании). Свет, действуя на молекулу, в которой сравнительно легко осуществляется окислительно-восстановительный процесс, может играть роль фактора, способствующего переносу электрона. Бромистое серебро под действием света разлагается таким образом, что электрон галогена переходит к иону серебра, вызывая его восстановление.
Br- + hν = Br + ē,
Ag+ + ē = Ag (кристаллы),
Br + Br = Br2.
2. Вторичные реакции - не требующие света (взаимодействие активных частиц с другими молекулами или друг с другом). Активные частицы, образовавшиеся в первичных процессах, могут передавать свою энергию молекулам другого вещества, а те затем вступать в химическую реакцию. Такой процесс называется сенсибилизацией.
Например - диссоциация водорода в присутствии паров ртути (пары ртути - фотосенсибилизаторы, ускоряющие фотохимическую реакцию):
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Hg + hν → Hg *,
Hg * + H2 → Hg + 2H ˙.
Если облучать молекулярный водород монохроматическим светом с длиной волны, соответствующей одной из спектральных резонансных линий ртути, то никакой диссоциации водорода не происходит. Но достаточно добавить к водороду незначительное количество паров ртути, как начинается диссоциация.
Рассмотрим основные законы фотохимии.
Закон Бугера-Ланберта-Беера (закон поглощения света, используется в спектроскопии): количество световой энергии, поглощенной раствором, пропорционально концентрации растворенного вещества и длине пути света в поглощающем веществе.
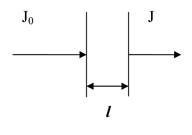 J = J0·10-ε с l,
J = J0·10-ε с l,
где J0 - интенсивность падающего света, J - интенсивность прошедшего света, l – расстояние, через которое проходит свет (длина кюветы), с - концентрация вещества, e - молярный коэффициент экстинции (характеризует оптические свойства растворенного вещества)
Закон Гроттуса-Дрепера: химически активным является лишь тот свет, который поглощается реакционной средой.
Пример: диссоциация водорода в присутствии паров ртути.
Важным является закон фотохимической эквивалентности Штарка-Эйнштейна: каждая молекула, реагирующая под действием света, поглощает один квант радиации, вызывающий реакцию.
Следовательно, количество энергии, поглощаемое 1 молем вещества:
Е = NA·hν = NA·h·c/λ, где NA - число Авогадро, h - постоянная Планка,
ν - частота колебаний, λ - длина волны, с - скорость света.
При опытной проверке закона фотохимической эквивалентности часто обнаруживаются расхождения с теорией, а именно, количество прореагировавшего вещества оказывается больше или меньше количества поглощенной энергии. Эти расхождения объясняются течением вторичных процессов и характеризуются величиной квантового выхода (обозначается, изменяется в интервале от 10-3 до 106):
φ = (число прореагирующих молекул) / (число поглощенных квантов).
1) Реакция с квантовым выходом φ =1. Это реакции, протекающие в одну стадию (отсутствуют вторичные процессы). Например, образование H2O2 из смеси О2 и Н2 или разложение сероводорода в бензольном растворе.
2) Реакция с квантовым выходом φ < 1. Например, важнейшая реакция синтеза углеводов в растениях:
СО2 + Н2О + hν → 1/6 C6Н12О6 + О2.
Эта реакция является термодинамически невозможной, а протекает за счет фотоэнергии. На одну молекулу требуется 8 квантов света (φ =1/8). Реакция сенсибилизируется хлорофиллом в виде сложных биологических структур - хлоропластов.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
3) Реакции с квантовым выходом φ > 1. Пример, реакция фотолиза HJ (φ =2):
HJ + hν → H ˙ + J ˙
H ˙ + HJ → H2 + J ˙
J ˙ + J ˙ → J2
2HJ + hν = H2 + J2.
4) Реакция с квантовым выходом Φ > > 1. Это фотокаталитические реакции, в которых свет выполняет функцию катализатора. Например, реакция образования HCl имеет φ ≈ 105 (цепная реакция): H2 + Cl2 → 2HCl. Радикал хлора, получившийся непосредственно в фотохимическом процессе, может затем регенерироваться во вторичных процессах, что приводит к большому квантовому выходу.
|
|
