
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Методы определения порядка реакции и константы скорости
|
|
В кинетике реакций простых и сложных типов решаются главным образом следующие задачи:
1. Прямая задача: известен порядок реакции и ее константа скорости. Требуется найти концентрацию какого-либо из исходных веществ или продуктов реакции в определенный момент времени или найти время, за которое концентрация какого-либо из реагентов или продуктов реакции достигает определенного значения.
2. Обратная задача: получены экспериментальные данные по кинетике ранее не изученной реакции. Требуется определить порядок реакции и константу скорости.
Для определения порядка реакции необходимо иметь экспериментальные данные об изменении концентрации реагирующих веществ со временем:
| с0 | с1 | с2 | с3 | с4 | ….. |
| t0 | t1 | t2 | t3 | t4 | ….. |
1. Метод подбора уравнений
Метод состоит в подстановке экспериментальных данных по концентрации веществ для каждого момента от начала реакции в кинетические уравнения различных порядков (этот прием ничего не дает, если порядок реакции превышает 3 или является дробным):
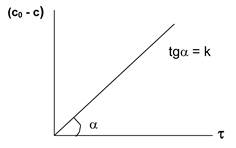
k = (с0 - с) /t = x/t (нулевой порядок);
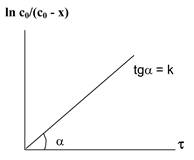
k = (1/t) lnс0/с (первый порядок);
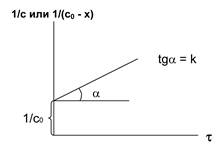
k = (1/t) x /с0с ( второй порядок).
Порядок реакции будет соответствовать тому уравнению кинетики, для которого при различных начальных концентрациях исходных веществ и в различные моменты времени при заданной температуре константа скорости будет величиной постоянной.
2. Графические интегральные методы
| 
| 
|
нулевой порядок: первый порядок второй порядок
Рис. 5.1. Изменение концентрации во времени для реакций различных порядков
Находят такую функцию от концентрации, отложив которую на графике, в зависимости от времени, получают прямую линию (рис. 5.1.).
3. По периоду полупревращения.
По зависимости периода полупревращения от начальной концентрации:
нулевой порядок: t1/2 = с0 /2k;
первый порядок: t1/2 = 0, 693/ k;
второй порядок: t1/2 = 1 / kс0.
В общем виде:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
t1/2 ≈ 1 /k с0 n-1.
Проводят опыты при двух различных начальных концентрациях (с0)’ и (с0)”:
(t1/2)’ = 1 /k (с0)1 n-1 (1)
(t1/2)” = 1 /k (с0)2n-1 (2)
Разделим (1) на (2):
(t1/2)’ / (t1/2)” = (с0)2 n-1 / (с0)1 n-1.
Прологарифмируем:
lg(t1/2)’ / (t1/2)” = (n-1) ´ lg[(с0)2 /(с0)1],
n = 1 + [lg(t1/2)’ - lg(t1/2)”] / [lg(с0)2 - lg(с0)1].
4. Дифференциальный метод (метод Вант-Гоффа)
Используют зависимость скорости реакции от концентрации при условии равенства концентраций всех исходных веществ (рис. 5.2.): W = kсn. Логарифмируем данное выражение: lgW = lgk + nlgс.
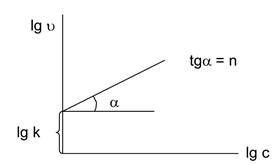
Рис. 5.2. Зависимость скорости реакции от концентрации
5. Интегральный метод Вант-Гоффа (по зависимости скорости реакции от начальной концентрации в первые моменты времени - 10-15 с).
W = k (c0 - x)n = k c0 n,
Так как в первый момент времени x ≈ 0.
Проводят опыт с различными начальными концентрациями.
W1 = k c1 n (1)
W2 = k c2 n (2)
Делим уравнение (1) на уравнение (2): W1 /W2 = (c1/ c2)n.
Логарифмируем:
n = (lgW1 - lgW2) / (lgс1 -lgс2),
где с1 и с2 берутся средними на исследуемом участке реакции, соответствующем Δ t.
6. Метод изолирования Оствальда
Запишем кинетическое уравнение реакции: W = kс A n1 ´ с B n2 ´ с с n3.
Увеличиваем концентрацию “В” и ”С” больше чем в 10 раз. Порядок по этим веществам будет нулевым, их концентрации не будут меняться. Определяем “n1” одним из тех методов, которые были рассмотрены выше. Так же поступаем, определяя порядок реакции по веществам В и С, т.е. n2 и n3.
|
|
