
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Критерии самопроизвольного протекания процессов
|
|
а) В изолированной системе самопроизвольно идут только процессы с увеличением энтропии. DS > 0 – процесс возможен, DS < 0 – невозможен. Когда S достигает максимума, наступает равновесие, макроскопические изменения прекращаются. Типичный пример – диффузия, которая происходит без теплового эффекта: система самопроизвольно переходит в состояние с максимальной вероятностью – молекулы, атомы, ионы перемешиваются.
б) Там, где возможен теплообмен с окружающей средой, это уже не совсем верно. Возможны экзотермические процессы с уменьшением S, например, кристаллизация жидкости, конденсация пара. Поэтому первоначально был введен критерий Бертло: самопроизвольно идут только экзотермические процессы, то есть процессы с уменьшением U или H. Этот критерий при низких температурах оправдывается часто. Действительно, потерять энергию проще, чем приобрести. Простая механическая аналогия: предмет на столе имеет большую потенциальную энергию, чем на полу, скатиться и упасть на пол он может самопроизвольно, но не может сам заскочить с пола на стол. Но все же и этот критерий не совсем верен. Возможны и эндотермические процессы, например, испарение жидкости.
Одновременно действуют обе тенденции – и стремление к минимуму энергии (U или H), и стремление к максимуму беспорядка (S). Нужны критерии, учитывающие сразу обе тенденции. Такими критериями являются:
энергия Гельмгольца F = U – TS для изохорно-изотермических процессов
и энергия Гиббса G = H – TS = U + pV – TS = F + pV – для изобарно-изотермических.
В старой литературе их еще называют термодинамическими потенциалами (изохорно-изотермическим и изобарно-изотермическим), а также свободными энергиями Гельмгольца и Гиббса.
Тут более прямая аналогия с механической потенциальной энергией: макротела самопроизвольно скатываются в яму, к минимуму потенциальной энергии, а физико-химические системы – к минимуму термодинамического потенциала.
В изохорно-изотермических условиях самопроизвольно идут только процессы с уменьшением F: DF < 0 – процесс возможен, DF > 0 – процесс невозможен. Когда F достигает минимума – наступает равновесие.
Аналогично, в изобарно-изотермических условиях самопроизвольно идут только процессы с уменьшением G.
DG = DH – TDS < 0 – условие самопроизвольного протекания процесса в изобарно-изотермических условиях. Возможны четыре варианта (рис. 5):
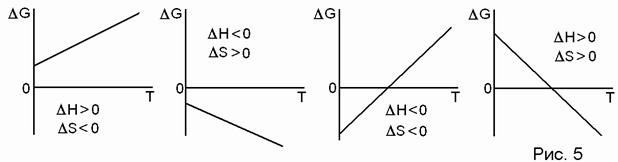
1) DН > 0, DS < 0. При любых температурах DG > 0, значит, прямой процесс невозможен.
2) DН < 0, DS > 0. При любых температурах DG < 0, значит, прямой процесс возможен.
3) DН < 0, DS < 0. Возможны разные знаки DG в зависимости от Т.
Если Т ® 0, то DG» DН и справедлив принцип Бертло. В данном случае прямой процесс может идти, обратный – нет.
Если Т ® ¥, то DG» –TDS, и направление процесса определяется ростом энтропии. В данном случае может идти только обратный процесс.
4) DН < 0, DS < 0. Случай, обратный предыдущему. Процесс идёт самопроизвольно лишь при высоких температурах
Но где граница между “низкими” и “высокими” температурами? Это зависит от соотношения DH и DS. Температура, при которой равновероятны прямой и обратный процессы (DG = 0): Т0 = DН/DS. Ниже этой температуры равновесие смещается в сторону протекания экзотермической реакции, выше – в сторону эндотермической. В качественной форме это известно как частный вариант принципа Ле Шателье. Очевидно, что при разных знаках DН и DS такой температуры не может быть.
Демонстрация: обратимое разложение NH4Cl ← → NH3 + HCl и необратимое (NH4)2Сr2O7 ® N2 + Cr2O3 + 2H2O. Знак DS очевиден по выделению газов, знак DH во втором случае также очевиден – саморазогрев.
Вопрос. Как изменяются H, S и G при реакции BaCl2(p-p) + H2SO4(p-p) → BaSO4(тв.) + 2HCl(p-p) в изобарно-изотермических условиях? в изолированной системе? Процесс идет самопроизвольно, значит в изобарно-изотермических условиях DG < 0. Но образование кристаллов позволяет утверждать, что DS < 0. Тогда однозначно DН < 0. Будет ли DН < 0 в изолированной системе? Нет, DН = 0, т.к. нет теплообмена. Система не может отдать тепло в окружающую среду, поэтому температура повышается. Но если процесс идет самопроизвольно, значит DS > 0. Но может ли кристаллизация идти с ростом энтропии? Кристаллизация – вряд ли, но раствор-то нагрелся, и рост его энтропии перевесил убыль энтропии от кристаллизации. Здесь DG = – ТDS < 0.
Для DF, DG и DS, как и для DU, DH, справедлив закон Гесса.
|
|