
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Влияние концентрации
|
|
При возрастании концентрации какого-то из веществ (исходных или продуктов) равновесие смещается в сторону его расходования, а при уменьшении концентрации – в сторону его образования. Это непосредственно следует из закона действия масс. Если существует равновесие aA + bB = xX + yY, то справедливо равенство
[X]0x[Y]0y / ([A]0a[B]0b) = K,
где нижний индекс ноль соответствует равновесному состоянию. Допустим, мы растворили без изменения объёма добавочное количество вещества Х, так что его концентрация стала выше, а остальные концентрации пока не изменились (момент 2 на рис. 4).
Тогда дробь стала больше константы равновесия, то есть равновесие нарушилось. Чтобы его восстановить, дробь должна уменьшиться. Ускоряется обратный процесс, реакция идет так, чтобы концентрации в числителе уменьшились, а в знаменателе увеличились. Рано или поздно дробь возвращается к исходному значению, то есть устанавливается новое равновесие с новыми концентрациями (помечены индексом 1): [X]1 > [X]0, [Y]1 < [Y]0, [A]1 > [A]0, [B]1 > [B]0.
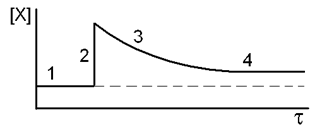
| Рис. 4. Схема изменения концентрации вещества Х во времени: 1) исходное равновесие; 2) увеличена концентрация Х, равновесие нарушено; 3) идет восстановление равновесия; 4) установилось новое равновесие. |
Можно ли в формулировке правила заменить “возрастание концентрации вещества” на “добавление вещества”? Нет, это может привести к ошибкам. Добавка вещества не всегда ведет к возрастанию его концентрации. Если вещество составляет отдельную твердую или жидкую фазу, то его концентрация постоянна и не подставляется в выражение закона действия масс, а автоматически учитывается в величине К. Поэтому добавка новых кусков твердой фазы не меняет концентраций и не смещает равновесия. Но даже если вещество растворимо, то не всякая его добавка ведет к росту его концентрации. Пример из практикума.
Студент: Что–то у меня реакция не идет.
Преподаватель: Там нужна высокая концентрация кислоты; добавьте еще.
Студент подливает из банки с надписью 0, 1 М HCl. Естественно, от этого концентрация кислоты скорее понизится, т.к. в исходной смеси она, вероятно, была выше 0, 1 М.
|
|