
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Решение. Простые (элементарные) реакции протекают в одну стадию
|
|
Простые (элементарные) реакции протекают в одну стадию. Сложные – суммарный результат протекания нескольких простых реакций
Простые реакции классифицируют по молекулярности. Молекулярность - число молекул, участвующих в элементарном химическом акте, целое число: 1, 2, реже 3.
Порядки реакции по веществам определяются экспериментально. В простых реакциях: n = 1, 2 редко 3 и общий порядок равен молекулярости, т.е. порядки реакции по веществам равны стехиометрическим коэициентам.
Т.к. по условию порядок реакции n = 2 и он совпадает со стехиометрическим коэффициентом перед исходным веществом в реакции НI, то реакция 2НI(г) ® Н2(г) + I2(г) элементарная, молекулярность и порядок реакции совпадают: реакция бимолекулярная, порядок n = 2, основное кинетическое уравнение: 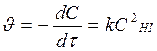 . (В простых реакциях порядки реакции по веществам равны стехиометрическим коэффициентам Þ
. (В простых реакциях порядки реакции по веществам равны стехиометрическим коэффициентам Þ 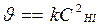 закон действующих масс для химической кинетики)
закон действующих масс для химической кинетики)
Период полупревращения τ 1/2: время, за которое прореагировала половина исходного количества вещества
Для реакции второго порядка
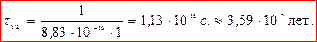
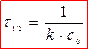
период полупревращения обратно пропорционален начальной концентрации (чем больше С0, тем τ 1/2 меньше).
Задача 4.
Для реакции первого порядка А ® 2В определите время, за которое
прореагирует 90 % вещества А. Константа скорости реакции k1 = 10-4 с-1.
Решение. После превращения 90 % вещества А его концентрация составит 10% от начальной концентрации, т. е. С = 0, 1 с0.
Основное кинетическое уравнение
Кинетическое уравнение реакции первого порядка: 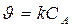 .
.
Решение кинетического уравнения lnC = lnC0 - kt
где С0 – исходная концентрация; С - концентрация в момент времени t
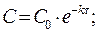
Время, за которое прореагирует 90% вещества 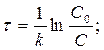
τ =(1/ 10-4)ln(C0/0, 1C0) = 23026 с = 6, 4 ч.
Задача 3.
В реакции А ® В + С с общим порядком, равным единице, константа скорости k1 = 5× 10-5 с-1. Определите концентрацию веществ А и В и скорость реакции через 1 час и через 5 часов, если начальная концентрация А составляла 0, 2 моль/л.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
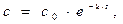 |
Решение. Для реакции 1-го порядка справедливо уравнение
где с – текущая концентрация вещества в момент времени τ, с0 – начальная концентрация, k – константа скорости, τ – время.
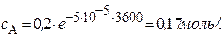
Через 1 час
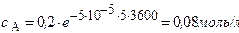 Через 5 часов
Через 5 часов
Таблица материального баланса
| Компонент | А | В | С |
| Начальные концентрации Сисх, моль/л | 0, 2 | ||
| Изменение концентраций ∆ С, моль/л | х= Сисх - С τ | х= Сисх - С τ | x |
| В момент времени τ С τ , моль/л | 0, 2-х | x | x |
Концентрация вещества В находится по стехиометрическому соотношению веществ А и В. Из уравнения реакции следует, что концентрация вещества В возрастает на ту же величину, на какую убывает концентрация А, т. к. из 1 моль А получается 1 моль В.
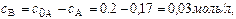 Поэтому через 1 час
Поэтому через 1 час
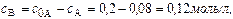 Через 5 часов
Через 5 часов 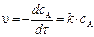
Рассчитаем скорость реакции по уравнению:
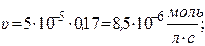 Через 1 час
Через 1 час

- через 5 часов
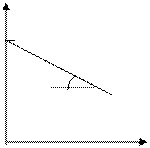
 lg C
lg C
lg C o
tga = k
t, с
|
|
