
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Влияние концентрации на скорость реакции. Условия протекания реакции A+B→ K +L:
|
|
Условия протекания реакции A+B→ K +L:
1 - одновременное нахождение А и В в определённой точке реакционного пространства;
2 - удачное их столкновение.
Вероятность (ω) нахождения молекулы для каждого из веществ прямо пропорциональна его концентрации: ω A = α × Cа A, ω B = β × C в B.
Вероятность одновременного нахождения обеих молекул в одной точке пространства, т.е. их столкновения: ω = ω A × ω B = α × Cа A × β × Cв B.
γ – доля удачных столкновений 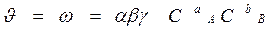
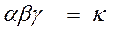
Уравнение, связывающее скорость реакции с концентрацией исходных веществ - кинетическое.
Основное кинетическое уравнение 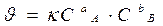
k - константа скорости:
а) не зависит от концентрации
б) зависит от температуры, природы реагирующих веществ, катализатора, площади поверхности раздела фаз.
k – удельная скорость: 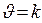 , если СА = С В = 1моль/л
, если СА = С В = 1моль/л
а, в – частные порядки реакции по веществам А и В (определяются экспериментально) n = (а + в) – общий порядок реакции
В простых реакциях: n = 1, 2 редко 3 и общий порядок равен молекулярости. H2 + I2 ® 2HI – простая (элементарная) реакция
а (Н2) = 1, в (I2) =1, т.е. порядки реакции по веществам равны стехиометрическим коэффициентам n = 1+1 =2 Þ
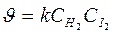 закон действующих масс для химической кинетики.
закон действующих масс для химической кинетики.
В сложных реакциях: n = 0, целочисленные, дробные, (-), (+) (определяются экспериментально)
|
|
