
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Задача 1. За 1 с в единице реакционного пространства образуется по трем реакциям 66 г СО2, 68 г Н2S и 51 г NН3
|
|
За 1 с в единице реакционного пространства образуется по трем реакциям 66 г СО2, 68 г Н2S и 51 г NН3. Скорость образования какого из веществ больше?
Решение. Количество вещества (ν) в молях каждого из продуктов реакции
 |
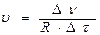 где R – реакционное пространство, D ν – изменение количества вещества за время D τ;
где R – реакционное пространство, D ν – изменение количества вещества за время D τ;
Скорость образования NН3 больше, чем скорости образования Н2S и СО2.
Простые (элементарные) реакции протекают в одну стадию.
Сложные – суммарный результат протекания нескольких простых реакций.
Простые классифицируют по молекулярности. Молекулярность - число молекул, участвующих в элементарном химическом акте:
целое (+) число: 1, 2, реже 3
1 – мономолекулярные: I2 ® 2I
2 – бимолекулярные: H2 + I2 ® 2HI
3 – тримолекулярные: 2NO + Cl2 ® 2NOCl
Запись простой реакции отражает механизм ее протекания, с ложной – не отражает механизма протекания процесса: 2N2O5 ® O2 + 2N2 O4
Стадияи:
1 N2O5 ® O2 + N2O3 быстро
2 N2O3 ® NO + NO2 медленно
3 2NO2 ® 2N2O4 быстро
медленная стадия (2) – лимитирующая стадия, определяет скорость
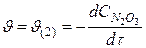
Cкорость реакции зависит от:
1) природы реагирующих веществ,
2) концентрации или давления реагирующих веществ,
3) температуры
4) катализатора
|
|
