
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Уравнения, связывающие концентрацию исходных веществ и время
|
|
(Т = const)
Реакции 1-ого порядка А ® В CH3OCH3® CH4 + H2 + CO
Кинетическое уравнение реакции первого порядка: 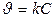 .
.
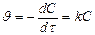 , l nC – lnC0 = -kt Þ lnC = lnC0 - kt
, l nC – lnC0 = -kt Þ lnC = lnC0 - kt
С0 – исходная концентрация, С - концентрация в момент времени t
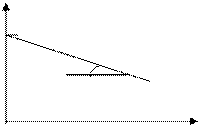
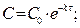
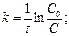
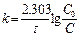 [ k ] =[с-1] Для реакций 1-ого порядка зависимость lgC от t линейная:
[ k ] =[с-1] Для реакций 1-ого порядка зависимость lgC от t линейная:
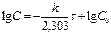 lg C
lg C
lg C o
t, с
период полупревращения τ 1/2: время, за которое прореагировала половина исходного количества вещества
C = 0, 5C0 Þ 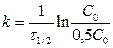
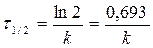 - не зависит от С о для n=1
- не зависит от С о для n=1
Реакции 2-ого порядка A + B → продукты или 2А ® продукты
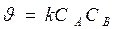 если C0 A = C0 B
если C0 A = C0 B 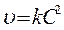
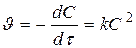
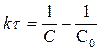
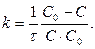 [л× моль-1× с-1]
[л× моль-1× с-1]
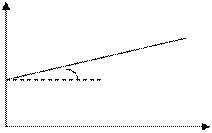 Для реакции 2-ого порядка зависимость 1/С от t линейная
Для реакции 2-ого порядка зависимость 1/С от t линейная 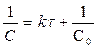
C
a tga = k
1/C0
t
Период полупревращения для реакций 2-ого порядка C = ½ C0 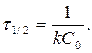
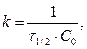 t ½ - обратно пропорционально начальной С0
t ½ - обратно пропорционально начальной С0
Реакции 0-го – порядка: С = С0 - kt; t1/2 = С0 /2k, [ k]= [моль л-1 с-1]
Реакции 3-его порядка: 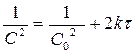 ;
; 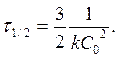 [k]= [моль-2 л2 с-1]
[k]= [моль-2 л2 с-1]
|
|
