
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Выбор индикаторов по конечным продуктам химической реакции
|
|
1) Титрование сильной кислоты сильным основанием и наоборот.
 |
HCl + KOH = KCl + H2O
В момент эквивалентности на рН раствора влияет слабый электролит H2O.
pН = 7
В момент эквивалентности точка эквивалентности будет совпадать с точкой нейтральности.
Индикаторы: фенолфталеин, метиловый оранжевый, метиловый красный.
2) Титрование слабой кислоты сильным основанием.
 |
CH3COOH + KOH = CH3COOK + H2O
В момент эквивалентности на рН раствора влияет CH3COOK, так как соль подвергается гидролизу.
 CH3COOК + НOH CH3COOН + КОН
CH3COOК + НOH CH3COOН + КОН
 CH3COO- + НOH CH3COOН + ОН-
CH3COO- + НOH CH3COOН + ОН-
рН > 7
В момент эквивалентности точка эквивалентности будет смещена в область щелочной среды.
Заканчивать титрование необходимо при рН > 7.
Индикатор: фенолфталеин.
3) Титрование слабого основания сильной кислотой.
 NH3× H2O + HCl = NH4Cl + H2O
NH3× H2O + HCl = NH4Cl + H2O
В момент эквивалентности на рН раствора влияет NH4Cl, так как соль подвергается гидролизу.
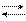 NH4Cl + НOH NH3× H2O + HCl
NH4Cl + НOH NH3× H2O + HCl
 NH4+ + НOH NH3× H2O + Н+
NH4+ + НOH NH3× H2O + Н+
рН < 7
В момент эквивалентности точка эквивалентности будет смещена в область кислой среды.
Заканчивать титрование необходимо при рН < 7.
Индикаторы: метиловый оранжевый, метиловый красный.
|
|
