
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гидролиз солей, образованных слабыми кислотами и слабыми основаниями
|
|
Катион и анион однозарядны
К такого типа солям относятся, в основном, соли аммония. В этом случае продуктами гидролиза являются слабые кислота и основание:
KtAn + Н2О = KtOH + HAn,
Kt+ + An- + H2O = KtOH + HAn,
где Kt+ и An- - катион и анион слабых основания и кислоты соответственно.
В этом случае константа гидролиза обратно пропорциональна произведению констант диссоциации обоих слабых электролитов:
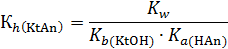
Если образующиеся в результате реакции основание и кислота являются электролитами равной силы, то раствор имеет нейтральную среду (рН = 7). В противном случае значение водородного показателя определяется соотношением констант диссоциации этих соединений. Например, при гидролизе фторида аммония
NH4F + H2O = NH3·Н2О + HF
водородный показатель раствора меньше семи, т.к. 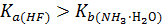
Для вычисления степени гидролиза и концентрации ионов Н+ можно воспользоваться формулами, выведенными по аналогии с предыдущими случаями:
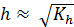 ;
; 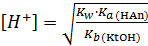
Гидролиз таких солей не зависит от концентрации соли в растворе и проходит намного глубже, чем в предыдущих случаях.
Катион – однозарядный, анион – многозарядный
Среди растворимых в воде солей к этой группе также относятся практически только соли аммония: (NН4)2СОз, (NH4)2S, (NH4)3PO4 и т.д.
(NH4)2S + H2O = NH3·Н2О + NH4HS
2NH4+ + S2- + H2O = NH3·Н2О + NH4+ + HS-
Следует отметить, что равновесие в этих случаях практически нацело смещено в сторону продуктов реакции. В результате, при гидролизе данной группы солей, в растворе образуется смесь гидрата аммиака и его соли. Причем концентрация основания равна концентрации соли. Среда в таких растворах щелочная (рН > 7).
Катион – многозарядный, анион – однозарядный
Такие соли не получены вследствие полного и необратимого гидролиза. Исключение составляют некоторые ацетаты и формиаты, которые при гидролизе дают осадки малорастворимых основных солей. Например:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Аl(СН3СОО)3 + Н2О = АlOH(СНзСОО)2 + СН3СООН
Al3+ + 3CH3COO- + H2O = A1OH(CH3COO)2 + CH3COOH
Катион и анион многозарядны
При внимательном рассмотрении таблицы растворимости видно, что в большинстве случаев такие соли нерастворимы в воде, вследствие этого их гидролизом можно пренебречь. В качестве исключения можно рассмотреть гидролиз сульфидов алюминия и хрома. Эти соли можно получить методами “сухой” химии, однако, если на них подействовать водой, произойдет полный и необратимый гидролиз:
A12S3 + 6Н2О = 2А1(ОН)3 + 3H2S
|
|
