
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Оксиды азота, устойчивость молекул, способы получения, свойства, применение.
|
|
Окси́ д азо́ та(I) (оксид диазота, закись азота, веселящий газ) — соединение с химической формулой N2O. Иногда называется «веселящим газом» из-за производимого им опьяняющего эффекта. При нормальной температуре это бесцветный негорючий газ с приятным сладковатым запахом и привкусом.
Строение молекулы оксида азота(I) описывается следующими резонансными формами:  Наибольший вклад вносит N-оксидная форма оксида азота(I). Порядок связи N-N оценивается как 2, 73, порядок связи N-O — как 1, 61. Резонансная структура с возможностью противоположного расположения зарядов в молекуле N2O обусловливает низкий дипольный момент молекулы, равный 0, 161 Дб.
Наибольший вклад вносит N-оксидная форма оксида азота(I). Порядок связи N-N оценивается как 2, 73, порядок связи N-O — как 1, 61. Резонансная структура с возможностью противоположного расположения зарядов в молекуле N2O обусловливает низкий дипольный момент молекулы, равный 0, 161 Дб.
Оксид азота(I) получают осторожным (опасность взрывного разложения!) нагреванием сухого нитрата аммония:

Более удобным способом является нагревание сульфаминовой кислоты с 73%-й азотной кислотой:

В химической промышленности закись азота является побочным продуктом и для её разрушения используют каталитические конвертеры, так как выделение в виде товарного продукта, как правило, экономически нецелесообразно.
Растворим в воде, этиловом спирте, эфире, серной кислоте.
Относится к несолеобразующим оксидам, с водой, с растворами щелочей и кислот не взаимодействует. Не воспламеняется, но поддерживает горение: тлеющая лучина, опущенная в него, загорается, как в чистом кислороде. Смеси с эфиром, циклопропаном, хлорэтаном в определённых концентрациях взрывоопасны. Оксид азота(I) является озоноразрушающим веществом, а также парниковым газом. В нормальных условиях N2O химически инертен, при нагревании проявляет свойства окислителя:


При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя:

При нагревании N2O разлагается:

Оксид азота(I) реагирует с амидами металлов с образованием соответствующих неорганических азидов:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение

При взаимодействии аммиака над катализатором образуется азид аммония:

Существует два вида закиси азота — пищевая, или медицинская «Медицинская» закись азота используется в основном как средство для ингаляционного наркоза, находит применение и в пищевой промышленности (например, для изготовления взбитых сливок) в качестве пропеллента. Как пищевой продукт, имеет индекс E942. Также иногда используется для улучшения технических характеристик двигателей внутреннего сгорания. В промышленности применяется как пропеллент и упаковочный газ. Может использоваться в ракетных двигателях в качестве окислителя, а также как единственное топливо в монокомпонентных ракетных двигателях.
28. Азотистая кислота, получение, свойства. Нитриты, получение и свойства.
Азо́ тистая кислота HNO2 — слабая одноосновная кислота, существует только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. Соли азотистой кислоты называются нитритами или азотистокислыми. Нитриты гораздо более устойчивы, чем HNO2, все они токсичны.
Азотистую кислоту можно получить при растворении оксида азота (III) N2O3 в воде:

Также она получается при растворении в воде оксида азота (IV) NO2:

Химические свойства.
В водных растворах существует равновесие:

При нагревании раствора азотистая кислота распадается с выделением NO и образованием азотной кислоты:

HNO2 является слабой кислотой. В водных растворах диссоциирует (KD=4, 6·10− 4), немного сильнее уксусной кислоты. Легко вытесняется более сильными кислотами из солей:

Азотистая кислота проявляет как окислительные, так и восстановительные свойства. При действии более сильных окислителей (пероксид водорода, хлор, перманганат калия) окисляется в азотную кислоту:



В то же время она способна окислять вещества, обладающие восстановительными свойствами:
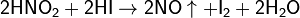
Нитриты — соли азотистой кислоты HNO2.
В промышленности нитриты получают поглощением нитрозного газа (NO + NO2) растворами гидроксида или карбоната натрия с образованием раствора нитрита натрия, из которого кристаллизацией получают сухой продукт. Нитриты других металлов получают обменной реакцией с нитритом натрия либо восстановлением соответствующих нитратов.
Химические свойства.
Нитриты являются термически малоустойчивыми соединениями. Так, без разложения могут плавиться только нитриты щелочных металлов, остальные же начинают разлагаться при 250—300 °C с выделением металла либо его оксида, азота, оксидов азота и кислорода.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Нитриты реагируют с солями меди, образуя комплексный гексонитритокупрат-анион, придающий раствору характерный зелёный цвет, что можно использовать в лаборатории как качественную реакцию.

Нитриты медленно разлагаются под действием кислот с выделением газа (продуктов разложения азотистой кислоты).
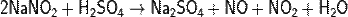
В горячей воде те же вещества реагируют с образованием оксида азота (II) и азотной кислоты:

Нитриты могут выступать как окислителями, так и восстановителями — в кислой среде они окисляются до нитратов, в щелочной способны восстанавливаться до оксида азота NO.
При взаимодействии нитритов со спиртами в кислой среде при пониженной температуре образуются органические нитриты:

29. Азотная кислота – получение, свойства, применение. Царская водка.
Азо́ тная кислота́ (HNO3) — сильная одноосновная кислота.
Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы. Азотная кислота — бесцветная, дымящая на воздухе жидкость. Известны два твёрдых гидрата: моногидрат (HNO3·H2O) и тригидрат (HNO3·3H2O).
Современный способ её производства основан на каталитическом окислении синтетического аммиака на платино-родиевых катализаторах (процесс Оствальда) до смеси оксидов азота (нитрозных газов), с дальнейшим поглощением их водой



Концентрация полученной таким методом азотной кислоты колеблется в зависимости от технологического оформления процесса от 45 до 58 %. Для получения концентрированной азотной кислоты либо смещают равновесие в третьей реакции путём повышения давления до 50 атмосфер, либо в разбавленную азотную кислоту добавляют серную кислоту и нагревают, при этом азотная кислота, в отличие от воды и серной кислоты, испаряется.
Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса:

Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой:

Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды.
|
|
