
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Общая, неорганическая и физическая химия.
|
|
1. Щелочные металлы – способы получения, химические свойства, применение. Гидриды – получение, химические свойства, применение.
Щелочны́ е мета́ ллы — элементы главной подгруппы I группы Периодической системы химических элементов Д. И. Менделеева: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Эти металлы получили название щелочных, потому что большинство их соединений растворимо в воде. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на новом энергетическом уровне: их электронная конфигурация ns1. Очевидно, что валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа. Поэтому для всех щелочных металлов характерны восстановительные свойства. Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия — один из самых низких) и электроотрицательности (ЭО).
Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Химические свойства щелочных металлов.
Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, азоту их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
1. Взаимодействие с водой. Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий.
При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
2. Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
Только литий сгорает на воздухе с образованием оксида стехиометрического состава.
При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2.
В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды.
Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода.
Для кислородных соединений щелочных металлов характерна следующая закономерность: по мере увеличения радиуса катиона щелочного металла возрастает устойчивость кислородных соединений, содержащих пероксид-ион О22-и надпероксид-ион O2-.
Для тяжёлых щелочных металлов характерно образование довольно устойчивых озонидов состава ЭО3. Все кислородные соединения имеют различную окраску, интенсивность которой углубляется в ряду от Li до Cs.
Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и кислотами.
Пероксиды и надпероксиды проявляют свойства сильных окислителей.
Пероксиды и надпероксиды интенсивно взаимодействуют с водой, образуя гидроксиды.
3. Взаимодействие с другими веществами. Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованием гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов, фосфидов, карбидов и силицидов.
При нагревании щелочные металлы способны реагировать с другими металлами, образуя интерметаллиды. Активно (со взрывом) реагируют щелочные металлы с кислотами.
Щелочные металлы растворяются в жидком аммиаке и его производных — аминах и амидах.
При растворении в жидком аммиаке щелочной металл теряет электрон, который сольватируется молекулами аммиака и придаёт раствору голубой цвет. Образующиеся амиды легко разлагаются водой с образованием щёлочи и аммиака.
Щелочные металлы взаимодействуют с органическими веществами спиртами (с образованием алкоголятов) и карбоновыми кислотами (с образованием солей).
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
4. Качественное определение щелочных металлов. Поскольку потенциалы ионизации щелочных металлов невелики, то при нагревании металла или его соединений в пламени атом ионизируется, окрашивая пламя в определённый цвет.
Литий служит сырьем в атомной энергетике, используется в ракетной технике. В металлургии применяется для удаления остатков водорода, азота, кислорода, серы. Гидроксидом дополняют электролит в щелочных аккумуляторах. Натрий необходим для атомной энергетики, металлургии, органического синтеза. Цезий и рубидий используются при изготовлении фотоэлементов. Широкое применение находят гидроксиды и соли, особенно хлориды, нитраты, сульфаты, карбонаты щелочных металлов. Катионы обладают биологической активностью, особенно важны для организма человека ионы натрия и калия.
Гидриды — соединения водорода с металлами и с имеющими меньшую электроотрицательность, чем водород, неметаллами.
Гидриды металлов – обладают только сильными восстановительными свойствами.
Химические свойства:
· Взаимодействие ионных гидридов с водой:
NaH + H2O → NaOH + H2↑
CaH2 + 2H2O → Ca(OH)2 + 2H2↑
· Взаимодействие с оксидами металлов:
2CaO + CaH2 → 2Ca + Ca(OH)2
3ZnO + 2AlH3 → 3Zn + 2Al + 3H2O
· Термическое разложение:
2LiH → 2Li + H2↑
2NaH → 2Na + H2↑
· Взаимодействие с азотом:
3СаН2 + N2 → Ca3N2 + ЗН2
Ионные гидриды получают взаимодействием простых веществ:
2Na + H2 → 2NaH
Гидриды широко применяются для проведения различных синтезов, для получения водорода и в химическом анализе. Гидрид кальция используется в качестве осушителя для удаления следов влаги.
Гидрид натрия 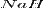 применяют для очистки железа от магнетита. В органической химии он используется в качестве конденсирующего и полимеризующего агента. Раствор
применяют для очистки железа от магнетита. В органической химии он используется в качестве конденсирующего и полимеризующего агента. Раствор 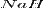 в гидроксиде натрия применяют для снятия окалины с тугоплавких металлов и специальных сталей.
в гидроксиде натрия применяют для снятия окалины с тугоплавких металлов и специальных сталей.
2. Кислородные соединения щелочных металлов – получение, свойства, применение. Соли, их свойства.
Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
· Только литий сгорает на воздухе с образованием оксида стехиометрического состава:

· При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2:
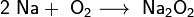
· В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды:

Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода:



Для кислородных соединений щелочных металлов характерна следующая закономерность: по мере увеличения радиуса катиона щелочного металла возрастает устойчивость кислородных соединений, содержащих пероксид-ион О22− и надпероксид-ион O2− .
Для тяжёлых щелочных металлов характерно образование довольно устойчивых озонидов состава ЭО3. Все кислородные соединения имеют различнуюокраску, интенсивность которой увеличивается в ряду от Li до Cs:
| Формула кислородного соединения | Цвет |
| Li2O | Белый |
| Na2O | Белый |
| K2O | Желтоватый |
| Rb2O | Жёлтый |
| Cs2O | Оранжевый |
| Na2O2 | Светло-жёлтый |
| KO2 | Оранжевый |
| RbO2 | Тёмно-коричневый |
| CsO2 | Жёлтый |
Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и кислотами:



Пероксиды и надпероксиды проявляют свойства сильных окислителей:

Пероксиды и надпероксиды интенсивно взаимодействуют с водой, образуя гидроксиды:
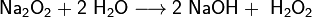

Солями называются сложные вещества, молекулы которых, состоят из атомов металлов и кислотных остатков (иногда могут содержать водород). Например, NaCl – хлорид натрия, СаSO4 – сульфат кальция и т. д.
Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Na+Cl– – хлорид натрия
Ca2+SO42– – сульфат кальция и т.д.
Соль является продуктом частичного или полного замещения металлом атомов водорода кислоты. Отсюда различают следующие виды солей:
1. Средние соли – все атомы водорода в кислоте замещены металлом: Na2CO3, KNO3 и т.д.
2. Кислые соли – не все атомы водорода в кислоте замещены металлом. Разумеется, кислые соли могут образовывать только двух- или многоосновные кислоты. Одноосновные кислоты кислых солей давать не могут: NaHCO3, NaH2PO4 ит. д.
3. Двойные соли – атомы водорода двух- или многоосновной кислоты замещены не одним металлом, а двумя различными: NaKCO3, KAl(SO4)2 и т.д.
4. Соли основные можно рассматривать как продукты неполного, или частичного, замещения гидроксильных групп оснований кислотными остатками: Аl(OH)SO4 , Zn(OH)Cl и т.д.
Соли – это твёрдые вещества, обладающие самой различной растворимостью в воде.
Химические свойства солей определяются свойствами катионов и анионов, которые входят в их состав:
1. Некоторые соли разлагаются при прокаливании:
CaCO3 = CaO + CO2↑
2. Взаимодействуют с кислотами с образованием новой соли и новой кислоты. Для осуществления этой реакции необходимо, чтобы кислота была более сильная, чем соль, на которую воздействует кислота:
2NaCl + H2 SO4 → Na2SO4 + 2HCl↑.
3. Взаимодействуют с основаниями, образуя новую соль и новое основание:
Ba(OH)2 + Mg SO4 → BaSO4↓ + Mg(OH)2.
4. Взаимодействуют друг с другом с образованием новых солей:
NaCl + AgNO3 → AgCl + NaNO3 .
5. Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO4 → FeSO4 + Cu↓.
|
|
