
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Розрахунки
|
|
1. Виміряний об’єм водню за атмосферних умов проведення досліду (Р, T) перераховуємо на нормальні умови за рівнянням Менделєєва-Клапейрона:
 ,
,
де – Р О, V О, T О тиск, об’єм та температура за нормальних умов, а Р, V, T -тиск, об’єм та температура за умов проведення досліду.
Тиск Р газів в бюретці (3) у відповідності до закону Дальтона дорівнює сумі парціальних тисків повітря РПОВ., водню Р(Н2) та насиченої водяної пари РПАРИ: Р = РПОВ + Р(Н2) + РПАРИ.
За однакових положень рівнів води в бюретках тиск РАТМ. = РПОВ. + Р(Н2) в бюретці (3) буде меншим від атмосферного на величину тиску насиченої водяної, яка залежить тільки від температури (таблиця 3):
Р = РАТМ. - РПАРИ.
Тоді, об’єм водню зведений до нормальних умов становить:
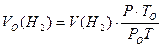 .
.
2. Виходячи з математичного виразу закону еквівалентів:
 ,
,
визначаємо молярну масу еквівалентівметалу МЕ:
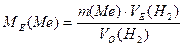
враховуючи те, що за нормальних умов водень займає еквівалентний об’єм, рівний:
 л/моль-екв,
л/моль-екв,
а використана в досліді маса металу m(Ме) витісняє з кислоти, об’єм водню VО(Н2), зведений до нормальних умов.
Таблиця 3
Залежність тиску насиченої парціальної пари від температури
| t, 0С | Па | мм рт.ст. | t, 0С | Па | мм рт.ст. |
| 2337, 8 | 17, 53 | ||||
| 1227, 9 | 9, 21 | 2486, 4 | 18, 65 | ||
| 1306, 6 | 9, 8 | 2643, 7 | 19, 83 | ||
| 1399, 9 | 10, 5 | 2809, 0 | 21, 07 | ||
| 1493, 2 | 11, 2 | 2983, 7 | 22, 38 | ||
| 1599, 9 | 3167, 2 | 23, 76 | |||
| 1705, 1 | 12, 79 | 3361, 0 | 25, 21 | ||
| 1817, 1 | 13, 63 | 3564, 9 | 26, 74 | ||
| 1947, 1 | 14, 53 | 3779, 6 | 28, 35 | ||
| 2063, 8 | 15, 48 | 4004, 9 | 30, 04 | ||
| 2197, 1 | 16, 48 | 4242, 2 | 31, 82 |
3. Після визначення молярної маси еквівалентів металу розраховуємо молярну масу металу для двох значень еквівалентного числа (валентності металу) Z, рівних 2 і 3 за рівнянням:
M(Ме) =MЕ(Ме) ·Z
За таблицею Д.Менделєєва вибираємо метал з відповідною валентністю, для якого розходження розрахованого значення молярної маси не перевищує 1 –2 г/моль.
4. Розраховуємо відносну похибку досліду:
Δ пох. = 
де МЕ ЕКСПЕР. – молярна маса еквівалентів металу, розрахована за отриманими під час досліду даними, МЕ ТЕОР. – теоретично розрахована молярна маса еквівалентів металу.
Контрольні завдання
1. Визначити еквівалентне число та чинник еквівалентності для таких речовин:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
а) Fe2O3, б) HClO4, в) NaHS, г) MgOHCl, д) Ca(OH)2.
2. Визначити об’єм карбон(ІІ) оксиду, необхідний для відновлення заліза з 1 кг ферум(ІІІ) оксиду за нормальних умов.
3. Визначити молярні маси еквівалентів Купруму та Сульфуру в їх оксидах Cu2O, CuO, SO2, SO3.
4. При окисненні 8, 91 г металу утворилося 9, 71 г його оксиду. Визначити молярну масу еквівалентів металу.
5. При розчиненні 0, 25 г металу в кислоті виділилося 50, 4 мл (н.у.) водню. Визначити молярну масу еквівалентів металу.
|
|
