
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоретична частина. Еквівалентом речовини (Е) – називається така частка формульної одиниці ФО речовини, яка рівноцінна одному йону гідрогену в кислотно-основних або йонообмінних
|
|
Еквівалентом речовини (Е) – називається така частка формульної одиниці ФО речовини, яка рівноцінна одному йону гідрогену в кислотно-основних або йонообмінних реакціях або одному електрону в окисно-відновних реакціях:
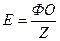
де Z – еквівалентне число.
Під формульною одиницею розуміють або реальні структурні одиниці речовин, здатні існувати самостійно (атоми, молекули, йони), або групи атомів, що входять до складу хімічних формул атомних чи йонних кристалів. Значення Z визначається за рівнянням хімічних реакцій, в якій приймає участь дана речовина:
1. Еквівалентне число Z чисельно дорівнює валентності елементу для простих речовин.
Розрахунок еквівалентів Феруму в реакціях:
а) Fe + H2SO4 (РОЗЧ.) = FeSO4 + H2;
Fe – 2e = Fe+2, еквівалентне число становить Z =2.
б) 2Fe +6H2SO4 (КОНЦ.) = Fe2(SO4)3 +3 SO2 + 6H2O.
Fe – 3e = Fe+3, еквівалентне число становить Z =3.
2. Для кислот еквівалентне число визначається основністю кислоти (кількістю йонів гідрогену, що заміщені на йони металу):
а) H3PO4 + NaOH = NaH2PO4 + H2O, Z(H3PO4) =1
б) H3PO4 + 2 NaOH = Na2HPO4 + 2H2O, Z(H3PO4) =2
в) H3PO4 + 3 NaOH = Na3PO4 + 3H2O, Z(H3PO4) =3
3. Для основ еквівалентне число визначається кислотністю основи (кількістю гідроксогруп заміщених аніонами кислоти):
а) Al(OH)3 + HCl = Al(OH)2Cl + H2O, Z (Al(OH)3) = 1
б) Al(OH)3 + 2HCl = Al(OH)Cl2 + 2H2O, Z (Al(OH)3) = 2
в) Al(OH)3 + 3HCl = Al(OH)3 + 3H2O, Z (Al(OH)3) = 3
4. Для солей та амфотерних оксидів еквівалентне число визначається добутком заряду катіону або аніону(за модулем) n на кількість катіонів (або аніонів) m:
Z = n·m
а) NaCl, Z =1·1=1;
б) Na2SO4, Z = 1·2=2;
в) Al2(SO4)3, Z=3·2=6.
5. Визначення еквівалентного числа речовини окисника та речовини відновника у окисно-відновних реакціях.
Еквівалентне число окисника та відновника у окисно-відновних реакціях визначається кількістю прийнятих чи відданих електронів.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
3 H2S + K2Cr2O7 + 4 H2SO4 = Cr2(SO4)3 + 3 S + K2SO4 + 7 H2O
відновник:  ,
,  ;
;
окисник: 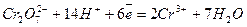 ,
,
За аналогією до молярної маси речовини вводиться поняття молярної маси еквівалентів речовини (Mекв(Х)) – маса одного моль еквівалентів речовини (г/моль-екв):
MЕ(Х) = 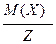 .
.
Для визначення молярних мас еквівалентів оксидів, основ, кислот і солей використовують формули:
 ;
;
 ;
;
 ;
;
 .
.
Молярний об’єм еквівалентів (VЕ(Х)) – об’єм одного моля газоподібної речовини (л/моль-екв).
Для простих двоатомних газів: 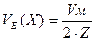 .
.
Для складних газоподібних речовин:  .
.
Німецькі хіміки: Венцель та Ріхтер встановили (1793 р.), що речовини реагують утворюються в еквівалентних кількостях:
nE(Х1) = nE(Х2), або  .
.
Якщо одним з учасників реакції є газоподібна речовина, закон еквівалентів можна записати у вигляді:
 .
.
Кількість речовини еквівалента 
Експериментально еквівалент елементу можна визначити хімічним шляхом – визначенням кількості приєднаного або заміщеного елементом Гідрогену, Оксигену або іншого елементу, еквівалент якого відомий, або електрохімічним шляхом на основі закону Фарадея, згідно якого при проходженні 1Ф електроенергії через розчин електроліту на електродах утворюється один еквівалент речовини.
В даній лабораторній роботі використовується найбільш простий спосіб визначення еквівалента металу, що базується на вимірюванні об’єму водню під час реакції його витіснення з розчину сульфатної кислоти:
Me + H2SO4 = MeSO4 + H2.
Згідно закону еквівалентів, один еквівалент металу витісняє один еквівалент водню, молярна маса еквівалентів якого становить 1 г/моль-екв.
|
|
