
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоретична частина. Кислотаминазивають речовини, які у водних розчинах дисоціюють на гідроген-катіони та аніони кислотних залишків.
|
|
Кислотами називають речовини, які у водних розчинах дисоціюють на гідроген-катіони та аніони кислотних залишків.
Кислоти поділяють на безоксигенні та оксигенні або оксигеновмісні. Безоксигенними кислотами є водні розчини сполук неметалів шостої та сьомої групи періодичної системи елементів з Гідрогеном: Н2S, H2Se, HCl, HBr, HF, HI, а також HCN, HCNS. Оксигеновмісні кислоти є гідратами (продуктами гідратації) кислотних оксидів (ангідридів кислот): H2SO3 – продукт гідратації SO2, H2SO4 – SO3, H2CrO4 – CrO3, HNO3 – N2O5, H3PO4 – P2O5.
Один і той же ангідрид (наприклад, фосфатний) може утворювати декілька кислот. Продукти мінімальної гідратації ангідридів називають мета-кислотами, а максимальної – орто-кислотами:
 - метафосфатна кислота;
- метафосфатна кислота;
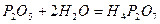 - дифосфатна кислота;
- дифосфатна кислота;
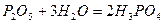 - ортофосфатна кислота.
- ортофосфатна кислота.
Число йонів гідрогену, які утворюються внаслідок дисоціації у водному розчині з однієї молекули кислоти, визначає основність кислоти. За основністю кислоти поділяють на одноосновні (HCl, HBr, HF, HI, HNO3), двоосновні (H2SO4, H2SiO3), триосновні (H3PO4, H3AsO4).
Кислотними залишками називають негативно заряджені йони, які утворюються в результаті відриву від молекули кислоти одного або кількох йонів гідрогену. Валентність кислотного залишку визначається числом йонів гідрогену, що відірвалися:
 - хлорид-аніон;
- хлорид-аніон;
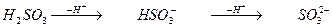 ;
;
гідрогенсульфіт-аніон сульфіт-аніон
 ;
;
дигідрогенфосфат- гідрогенфосфат- фосфат-
аніон аніон аніон
Кількість кислотних залишків відповідає кількості атомів Гідрогену у кислоті, тобто її основності.
Назви кислот складаються з назви елемента, характерного для кислотного залишку, вказуючи при необхідності ступінь окиснення та відповідного суфікса. Якщо оксигеновмісна кислота містить елемент у найвищому ступені окиснення, то його можна не вказувати.
Розчинні у воді кислоти отримують внаслідок прямої гідратації ангідридів кислот:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
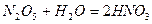 ;
;  .
.
Нерозчинні у воді кислоти можна одержати непрямою гідратацією їх нерозчинних у воді ангідридів. Спочатку нерозчинний оксид переводять у розчинну сіль, а потім дією сильної кислоти добувають відповідну нерозчинну кислоту:
 ;
;  .
.
силікатна кислота
Таблиця 1
Систематичні назви кислот та кислотних залишків
| Формула кислоти | Систематична назва | Формула кислотного залишку | Назва кислотного залишку |
| HCl | Хлоридна | Cl- | Хлорид |
| HBr | Бромідна | Br- | Бромід |
| HF | Флуоридна | F- | Флуорид |
| HI | Йодидна | I- | Йодид |
| HNO3 | Нітратна | NO3- | Нітрат |
| HNO2 | Нітратна(ІІІ), нітритна | NO2- | Нітрит |
| H2CO3 | Карбонатна | CO32- | Карбонат |
| H2SO4 | Сульфатна | SO42- | Сульфат |
| H2SO3 | Сульфатна(ІV), сульфітна | SO32- | Сульфіт |
| Н2S | Сульфідна | S2- | Сульфід |
| H2SiO3 | Силікатна | SiO32- | Силікат |
| H3PO4 | Ортофосфатна, фостфатна | PO43- | Ортофосфат, фосфат |
Найважливіша хімічна властивість кислот – здатність реагувати з основами, в результаті чого утворюються сіль і вода. Така реакція називається реакцією нейтралізації:
 ;
;
 .
.
Солями називають складні речовини, які у водних розчинах дисоціюють на катіони основних та аніони кислотних залишків. Солі поділяють на середні, кислі та основні.
Середні солі – це продукти повної взаємної нейтралізації кислоти і основи:
 ;
;
калій сульфат
 .
.
амоній хлорид
Середні солі бувають прості, подвійні, змішані, комплексні. Солі, які у водному розчині дисоціюють на два основних і один кислотний залишки, називають подвійними:
 ;
;
калій магній хлорид
 .
.
алюміній калій сульфат
В назвах подвійних солей катіони перелічуються у алфавітному порядку.
Солі, які у водному розчині дисоціюють на два кислотних і один основний залишки, називають змішаними:
 .
.
кальцій гіпохлорид-хлорид
В назвах змішаних солей аніони перелічуються у алфавітному порядку.
Солі, які у водних розчинах дисоціюють на комплексні йони, називають комплексними:

калій гексаціонаферат(ІІ)
Кислі солі - продукти часткової нейтралізації багатоосновних кислот основами:
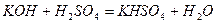 ;
;
калій гідрогенсульфат
 .
.
калій дигідрогенфосфат
При додаванні лугів кислі солі перетворюються на середні:
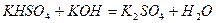 .
.
Кислі солі утворюються при додаванні кислоти до середньої солі:
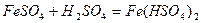 .
.
ферум(ІІ) гідрогенсульфат
Основні солі – продукти часткової нейтралізації багато- кислотних основ кислотами:
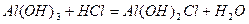 ,
,
алюміній дигідроксид хлорид
 .
.
алюміній гідроксид хлорид
Основні солі утворюються при взаємодії лугу з надлишком середньої солі:
 ;
;
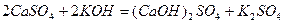 .
.
кальцій гідроксид сульфат
При додаванні кислоти малорозчинні основні солі перетворюються у розчинні середні солі:
 ,
,
а при додаванні лугу – у відповідну нерозчинну основу:
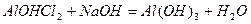 .
.
При змішуванні кислих та основних солей відбувається їх взаємна нейтралізація:
 .
.
ферум(ІІ) ферум(ІІ)
гідрогенсульфат гідроксид сульфат
|
|
