
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Закон рівномірного розподілу енергії за ступенями вільності молекул
|
|
Для того, щоб визначити енергію, яка припадає на всі рухи молекул, необхідно ввести поняття про число ступенів вільності.
 Числом ступенів вільності називають найменше число координат, які необхідно задати для того, щоб повністю визначити положення тіла у просторі, або кількість незалежних рухів, які може виконувати тіло.
Числом ступенів вільності називають найменше число координат, які необхідно задати для того, щоб повністю визначити положення тіла у просторі, або кількість незалежних рухів, які може виконувати тіло.
У класичній статистичній фізиці виводиться закон Больцмана про рівномірний розподіл енергій за ступенями вільності молекул:
для статистичної системи, що перебуває у стані термодинамічної рівноваги, на кожний поступальний і обертальний ступінь вільності припадає в середньому кінетична енергія, що дорівнює 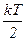 , а на кожний коливальний ступінь вільності – в середньому енергія
, а на кожний коливальний ступінь вільності – в середньому енергія 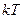 .
.
Коливальний ступінь має вдвоє
більшу енергію тому, що на нього припадає не лише кінетична енергія, як у разі поступального і обертального руху, але і потенціальна енергія, причому середні значення кінетичної і потенціальної енергій однакові:
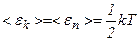 .
.
Таким чином, середня енергія молекули
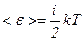 ,
,
де 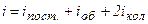 .
.
Важливою характеристикою термодинамічної системи є її внутрішня енергія
U – енергія хаотичного (теплового) руху мікрочастинок системи (молекул, атомів, електронів, ядер і тощо) і енергія взаємодії цих частинок.
В ідеальному газі немає сил взаємодії між молекулами, а, отже, дорівнює нулю взаємна потенціальна енергія молекул. Тому для моля ідеального газу внутрішня енергія дорівнює сумі кінетичних енергій 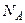 молекул:
молекул:
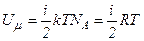 .
.
Якщо є 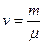 молів газу, то його внутрішня енергія
молів газу, то його внутрішня енергія
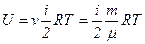 .
.
Внутрішня енергія ідеального газу залежить від кількості ступенів вільності молекул і абсолютної температури газу.
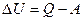 , або
, або 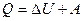 .
.
Це рівняння є математичним виразом першого закону термодинаміки:
теплота, надана системі, витрачається на збільшення її внутрішньої енергії і на виконання системою роботи проти зовнішніх сил.
Вираз для першого закону термодинаміки для нескінченно малої зміни стану системи матиме вигляд:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
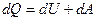
або в коректнішій формі
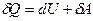 ,
,
де 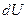 – нескінченно мала зміна внутрішньої енергії системи,
– нескінченно мала зміна внутрішньої енергії системи, 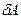 – нескінченно мала робота,
– нескінченно мала робота, 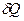 – нескінченно мала кількість теплоти. У цьому виразі
– нескінченно мала кількість теплоти. У цьому виразі 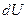 є повним диференціалом, а
є повним диференціалом, а 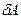 і
і 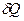 не є повними диференціалами, а функціоналами і залежать від вигляду функції, що описує перехід з одного стану в другий.
не є повними диференціалами, а функціоналами і залежать від вигляду функції, що описує перехід з одного стану в другий.
Дуже важливим є випадок, коли
система – це періодично діюча машина, в якій газ, пара або інше “робоче тіло” внаслідок деякого процесу повертається до початкового стану. У цьому разі
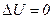 і
і 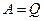 .
.
Робота, що виконується машиною за один цикл, дорівнює підведеній ззовні теплоті 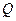 . Цей висновок дає змогу сформулювати перший закон термодинаміки так:
. Цей висновок дає змогу сформулювати перший закон термодинаміки так:
неможливо побудувати періодично діючий двигун, який виконував би роботу без підведення енергії ззовні або виконував би роботу більшу, ніж кількість переданої йому ззовні енергії (вічний двигун першого роду неможливий).
Для характеристики теплових властивостей газу, як i будь-якого iншoгo тіла, користуються особливою величиною – теплоємністю.
Теплоємністю тіла називається фізична величина, яка числово дорівнює кількості теплоти, яку потрібно надати тілу, щоб підвищити його температуру на один кельвін:
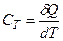 .
.
Значення 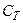 залежить від маси тіла, його хімічного складу, термодинамічного стану i виду процесу зміни стану тіла, в якому надходить теплота
залежить від маси тіла, його хімічного складу, термодинамічного стану i виду процесу зміни стану тіла, в якому надходить теплота 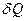 .
.
Питомою теплоємністю c називається фізична величина, що числово дорівнює кількості теплоти, яку слід надати одиниці маси цієї речовини для підвищення її температури на 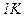 :
:
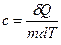 .
.
Молярною теплоємністю C називається фізична величина, яка числово дорівнює кількості теплоти, яку треба надати одному молю речовини для підвищення його температури на 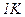 :
:
 ,
,
де 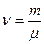 – кількість молей газу.
– кількість молей газу.
Між молярною теплоємністю 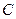 і питомою теплоємністю
і питомою теплоємністю 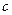 існує співвідношення:
існує співвідношення: 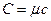 .
.
Якщо нагрівають газ, то згідно з
першим законом термодинаміки
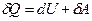 ,
,
а для одного моля газу
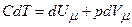 .
.
Якщо газ нагрівається при сталому об’ємі, то надана газу теплота йде лише на збільшення його внутрішньої енергії:
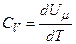 .
.
Якщо газ нагрівається при сталому тиску, то
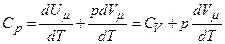 .
.
Тут враховано, що 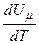 не залежить від виду процесу, оскільки внутрішня енергія ідеального газу не залежить ні від
не залежить від виду процесу, оскільки внутрішня енергія ідеального газу не залежить ні від 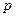 , ні від
, ні від 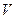 , а визначається лише температурою. Тому завжди
, а визначається лише температурою. Тому завжди 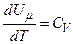 .
.
Згідно з рівнянням Клапейрона-Менделєєва
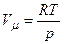 і
і 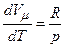 .
.
В результаті
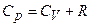 .
.
Отриманий вираз називається рівнянням Майєра.
Оскільки
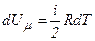 ,
,
то
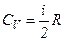 і
і 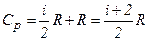 .
.
Кожний газ характеризується величиною
 і
і 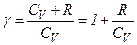 .
.
Звідси
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
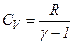 .
.
Отримані вирази для 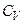 і
і 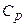 добре збігаються з експериментом для одноатомних і багатьох двоатомних газів при кімнатній температурі
добре збігаються з експериментом для одноатомних і багатьох двоатомних газів при кімнатній температурі 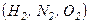 . Однак у
. Однак у 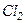
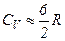 , що неможливо пояснити. У триатомних газів спостерігаються систематичні відхилення від теорії.
, що неможливо пояснити. У триатомних газів спостерігаються систематичні відхилення від теорії.
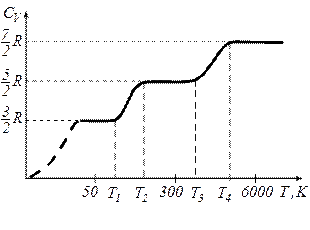
Експеримент показав, що теплоємність залежить від температури. Водночас згідно з формулами для 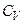 і
і 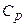 вона стала для даного газу.
вона стала для даного газу.
Графічно залежність теплоємності 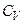 водню від температури показано на рисунку. При низьких температурах до температури
водню від температури показано на рисунку. При низьких температурах до температури 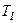
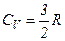 .
.
Ізопроцесами в газах називаються процеси, при яких один із основних параметрів стану 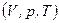 зберігається сталим.
зберігається сталим.
|
|
