
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лабораторна робота 8
|
|
АЗОТВМІСНІ СПОЛУКИ
Контрольні питання
1. Розташуйте в ряд за збільшенням оснό вних властивостей такі аміни: метиламін, диметиламін, триметиламін, анілін, дифеніламін.
2. За допомогою яких реакцій можна розрізнити первинні, вторинні та третинні аміни жирного ряду?
3. Поясніть легкість бромування аніліну, порівняйте з бромуванням бензолу.
4. Чому утворюються різні продукти при взаємодії з азотистою кислотою жирних і ароматичних амінів?
5. Чому анілін не можна нітрувати концентрованою азотною кислотою?
6. Чому реакцію діазотування здійснюють при температурі 0 - 50С?
7. Які типи реакцій характерні для діазосполук?
8. Чому азосполучення хлористого фенілдіазонію з β -нафтолом проводять у лужному середовищі, а з диметиланіліном - у слабо кислому?
9. Поясніть процеси, що відбуваються при " льодяному фарбуванні".
10. З аніліну одержіть йодбензол, бензонітрил, метилоранж
11. Напишіть реакції відновлення нітробензолу в кислому, нейтральному та лужному середовищах і назвіть проміжні продукти відновлення.
12. Що є джерелом водню при відновленні нітробензолу?
13. Як визначити кінець реакції відновлення нітробензолу і процесу перегонки з водяною парою?
14. Для чого реакційну суміш у наведеній далі методиці обробляють NаОН і чому це роблять перед перегонкою з водяною парою?
15. Поясніть суть фізико-хімічних процесів, що відбуваються при перегонці з водяною парою.
16. Що таке " висолювання", в яких випадках його застосовують і які процеси відбуваються при цьому?
17. Реакція діазотування і умови, в яких вона відбувається.
18. Які активні агенти діазотування беруть участь у реакції?
19. Як залежить швидкість реакції діазотування від будови вихідного аміну і умов реакції?
20. Яку роль відіграє мінеральна кислота і яка кількость її необхідна для реакції?
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
21. Як контролюють кислотність середовища і визначають появу надлишку азотистої кислоти при діазотуванні?
Органічні сполуки, що містять атоми азоту можна поділити на:
нітросполуки R-NO2;
нітрати R-O-NO2;
аміди карбонових кислот R-CONH2;
нітрили R-CN.
Подібно вуглецю, азот у різних сполуках може знаходитися в станах sp3, sp2 або sp-гібридизації.
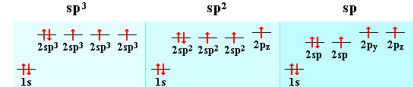
Будова і, отже, властивості сполук азоту визначаються характером його хімічних зв'язків і типом гібридизації, що впливає на форму молекули.
За рахунок трьох одноелектронних атомних орбіталей (АО) азот здатний до утворення трьох ковалентних зв'язків з іншими атомами за обмінним механізмом. У цьому випадку азот виявляє валентність 3 і має неподілену електронну пару. Такий атом азоту може виступати донором пари електронів, утворити четвертий зв'язок за донорно-акцепторним механізмом. При цьому азот набуває максимальної валентності 4 (максимальна валентність атома визначається числом його зовнішніх атомних орбіталей; в азоту їх чотири - одна 2s і три 2p). Чотиривалентний азот несе на собі позитивний заряд і може брати участь в утворенні іонного зв'язку (подібно іону амонію [NH4]+).
Електронегативність азоту, водню, вуглецю і кисню дорівнюють, відповідно, 3, 0; 2, 1; 2, 5 і 3, 5. Значення величин різниці між електронегативностями азоту і багатьох неметалів відносно невеликі. Тому зв'язки азоту з Н, С чи О є ковалентними полярними. У зв'язках тривалентного азоту з вуглецем або воднем електронна густина зміщена до більш електронегативного атома азоту, створюючи на ньому частковий негативний заряд, а на вуглеці або водні - частковий позитивний. У зв'язках азоту з киснем, навпроти, електронна густина зміщена від атома азоту до атома кисню, електронегативність якого вища. Зв'язок з чотиривалентным азотом, що несе позитивний заряд, відрізняється більш високою полярністю.
Розподіл електронної густини на атомах у молекулі визначає її реакційну здатність.
Аміни – органічні похідні аміаку NH3, у молекулі якого один, два чи три атоми водню заміщені на вуглеводневі радикали:
RNH2, R2NH, R3N.
Аміни класифікують за двома структурними ознаками:
· За кількістю радикалів, зв'язаних з атомом азоту, розрізняють первинні, вторинні і третинні аміни.
· За характером вуглеводневого радикала аміни підрозділяються на аліфатичні (жирні), ароматичні і змішані (або жирноароматичні).
| Аміни | Первинні | Вторинні | Третинні |
| Аліфатичні (жирні) | CH3NH2 Метиламін | (CH3)2NH Диметиламін | (CH3)3N Триметиламін |
| Ароматичні | C6H5NH2 Феніламін(анілін) | (C6H5)2NH Дифеніламін | (C6H5)3N Трифеніламін |
| Змішані | - | C6H5-NH-СН3 Метилфеніламін | C6H5-N(СН3)2 Диметилфеніламін |
Виходячи з розподілу електронної густини в молекулі і наявності неподіленої пари електронів на азоті, можна вважати, що аміни мають основні і нуклеофільні властивості.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Нуклеофільність - здатність частинки надати електронну пару на утворення зв'язку з вуглецем.
Крім того, атоми азоту в амінах мають низькі ступені окиснення (< 0). Тому аміни легко окиснюються за участю зв'язків C–N і N–H.
Водні розчини аліфатичних амінів виявляють лужну реакцію, тому що при їхній взаємодії з водою утворяться гідроксиди алкіламонію, аналогічні гідроксиду амонію:
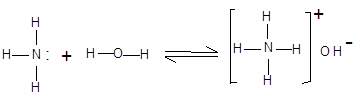 |
гідроксид амонію
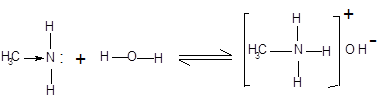 |
гідроксид метиламонію
Зв'язок протона з аміном, як і з аміаком, утвориться за донорно-акцепторним механізмом за рахунок неподіленої електронної пари атома азоту. Аліфатичні аміни – більш сильні основи, ніж аміак, тому що алкільні радикали збільшують електронну густину на атомі азоту за рахунок + I-ефекту. З цієї причини електронна пара атома азоту утримується менш міцно і легше взаємодіє з протоном.
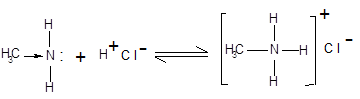 |
При взаємодії з кислотами, аміни утворюють солі:
хлорид метиламонію
Ароматичні аміни є більш слабкими основами, ніж аміак, оскільки неподілена електронна пара атома азоту зміщається убік бензольного кільця, вступаючи в спряження з його -електронами.
 |
Зменшення електронної густини на атомі азоту приводить до зниження здатності відщеплювати протони від слабких кислот.
З цих причин анілін взаємодіє лише із сильними кислотами (HCl, H2SO4), а його водний розчин не забарвлює лакмус у синій колір.
Оснó вність аміна тим вища, чим більша електронна густина зосереджена на атомі азоту. Ароматичні аміни внаслідок спряження неподіленої пари електронів азоту з π -електронною хмарою бензольного ядра є більш слабкими основами, причому цей ефект підсилюється при введенні і ароматичне кільце електроноакцепторних груп. Завдяки + I -ефекту алкільної групи аліфатичні аміни (особливо третинні) мають більшу електронну густину на атомі азоту, ніж аміак, і отже, більшу основність. Таким чином, основні властивості амінів змінюються в ряді:
C6H5NH2 < NH3 < RNH2 < R2NH < R3N (у газовій фазі)
Аміни, особливо ароматичні, легко окиснюються на повітрі. На відміну від аміаку, вони здатні спалахувати на повітрі при підпалюванні:
4СH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2
Вид продукту реакції з азотистою кислотою залежить від характеру аміну. Так, первинні аліфатичні аміни c HNO2 утворюють спирти:
R-NH2 + HNO2 → R-OH + N2 + H2O
Вторинні аміни (аліфатичні й ароматичні) під дією HNO2 перетворюються в нітрозосполуки (речовини з характерним запахом):
R2NH + H-O-N=O → R2N-N=O + H2O
алкілнітрозамін
Реакція з третинними амінами приводить до утворення нестійких солей і не має практичного значення.
Найважливішим з ароматичних амінів є анілін (феніламін, амінобензол) С6H5NH2.
Для аніліну характерні реакції як за аміногрупою, так і за бензольним кільцем. Особливості цих реакцій обумовлені взаємним впливом атомів. З одного боку, бензольне кільце послабляє основні властивості аміногрупи у порівнянні аліфатичними амінами і навіть з аміаком. З іншого боку, бензольне кільце під впливом аміногрупи стає більш активним у реакціях заміщення, ніж бензол.
Аміногрупа - замісник 1-го роду (активуючий орто-пара -орієнтант у реакціях електрофільного заміщення в ароматичному ядрі). Такий взаємний вплив атомів у молекулі аніліну пояснюється спряженням π -електронів бензольного кільця з неподіленою електронною парою атома азоту (+ M -ефект аміногрупи):
Практичне значення має реакція взаємодії аніліну з азотистою кислотою при зниженій температурі (близько 0оС). У результаті цієї реакції (реакції діазотування) утворюються солі діазонію, що використовуються в синтезі азобарвників і ряду інших сполук.
0oC
C6H5NH2 + KNO2 +2HCl → [C6H5-N≡ N]+ Cl- + KCl + 2H2O
анілін хлорид фенілдіазонію
При більш високій температурі реакція йде з виділенням азоту й анілін перетворюється у фенол:
toC
С6H5-NH2 + NaNO2 + HCl → С6H5-OH + N2↑ + NaCl + H2O
Подібно аніліну реагують з азотистою кислотою інші первинні ароматичні аміни. В основі цих перетворень лежить реакція нуклеофільного заміщення галогену в галогеналканах. Роль нуклеофіла відіграють молекули аміаку і амінів, що мають неподілену пару електронів на атомі азоту.
8.1. Одержання метиламіну з ацетаміду (реакція Гофмана)
Дослід проводять у витяжній шафі!
В пробірку з газовідвідною трубкою поміщають суміш рівних кількостей (по 0, 5 г) ацетаміду, хлорного вапна та гашеного вапна, прибавляють краплю води. Кінець газовідвідної трубки опускають у пробірку з 3 мл дистильованої води і охолоджують льодом. Реакцій-ну суміш нагрівають у полум’ї пальника, помічають запах метиламі-ну, що виділяється. Записують рівняння реакції і спостереження в лабораторний журнал. (Розчин метиламіну зберігають для подаль-ших дослідів).
8.2. Одержання метиламіну з його солей
Дослід проводять у витяжній шафі!
Наливають у пробірку 0, 5 - 1 мл розчину солянокислого метиламіну і 0, 5 мл 30%-го розчину гідроксиду натрію. Закривають пробірку пробкою з газовідвідною трубкою, кінець трубки опус-кають у пробірку з дистильованою водою (цю пробірку охолоджу-ють льодом). Реакційну суміш нагрівають і помічають запах метил-аміну, що виділяється.
Записують рівняння реакції. Розчин метиламіну зберігають для подальших дослідів.
8.3. Оснó вні властивості метиламіну
а) Краплю водного розчину метиламіну скляною паличкою наносять на лакмусовий папір.
б) В пробірку вміщюють 2 краплі водяного розчину метиламі-ну і додають одну краплю фенолфталеїну.
Записують спостереження і роблять висновок про реакцію середовища водяного розчину метиламіну та його рН.
8.4. Взаємодія метиламіну з азотистою кислотою
У пробірку, що занурена в стакан з льодом, поміщають 5 крапель розчину метиламіну, 10 крапель 2 М розчину HCl і 5 крапель нітриту натрію. Потім пробірку виймають з стакана і спостерігають виділення газу (якого?). Записують рівняння реакції.
Для цього досліду можна використати і розчин солянокислого метиламіну. У пробірці змішують 0, 1 г солі метиламіну з 0, 5 мл води і 0, 5 мл 10%-го розчину нітриту натрію. До суміші додають декілька крапель концентрованої оцтової кислоти (виділення газу!).
Записують рівняння реакції.
8.5. Оснó вні властивості аніліну
Поміщають у пробірку 0.5 - 1 мл аніліну, додають 3 - 4 мл води і струшують до утворення емульсії. Який висновок можна зробити про розчинність аніліну у воді? Скляною паличкою наносять краплю емульсії на індикаторний папір і записують спостереження. У пробірку наливають 0, 5 мл водяного розчину аніліну, додають 1-2 краплі концентрованої соляної кислоти. Яка сполука утворюється і що можна сказати про її розчинність у воді? У другу пробірку поміщають 0, 5 мл водяного розчину аніліну і додають 1-2 краплі концентрованої сірчаної кислоти (надіти окуляри!) і струшують суміш. Записують спостереження і порівнюють основні властивості аніліну і метиламіну.
8.6. Бромування аніліну
До 1 мл водного розчину аніліну, який одержано в досліді 5, додають краплями бромну воду.
Записують спостереження і рівняння реакції.
8.7. Реакція аніліну з хромовою сумішшю
До 1 мл водного розчину аніліну додають декілька крапель хромової суміші.
Записують спостереження і рівняння реакції.
8.8. Одержання основи Шиффа і аніліноформальдегідної смоли
У пробірку поміщають 2-3 краплі аніліну і стільки ж 40%-го розчину формальдегіду, закривають пробкою і струшують до утворення білого аморфного осаду, основи Шиффа.
Осад промивають водою і етиловим спиртом (декантація), додають 1 краплю оцтової кислоти і нагрівають у полум’ї пальника до сплавлення.
Записують спостереження і рівняння реакції.
8.9. Ізонітрильна проба на первинні аміни
У пробірці змішують анілін з спиртом і швидко приливають при струшуванні розчин лугу, а потім хлороформ. Реакційну суміш слабко нагрівають до кипіння і нюхають (обережно!).
8.10. Взаємодія дифеніламіну з азотною кислотою
До 0, 5 мл розчину дифеніламіну в концентрованій сірчаній кислоті додають по стінкам пробірки декілька крапель азотної кислоти. Що спостерігається? Що відбувається при виливанні суміші у воду?
8.11. Нітрозування дифеніламіну
Дифеніламін розчиняють у спирті і одержаний розчин охолод-жують у бані з льодяною водою. До охолодженого розчину прилива-ють соляну кислоту, а потім краплями насичений розчин азотисто-кислого натрію.
Пробірку періодично струшують.
Що спостерігається? Запишіть рівняння реакції.
Примітка. Якщо при охолодженні спиртового розчину дифеніламіну випадають кристали, то додаванням спирту, їх переводять знову у розчин. Реакцію нітрозування краще проводити при температурі не вищої за 0оС.
8.12. Взаємодія аніліну з азотистою кислотою (діазотування)
В конічній колбі готують розчин солянокислого аніліну з 1 мл аніліну і 10 мл 10%-ї соляної кислоти. Колбу розміщають у бані з льодом і охолоджують реакційну суміш до 50С. При охолодженні в колбу приливають краплями при постійному перемішуванні 1, 5 - 2 мл 10%-го розчину нітриту натрію. Кінець діазотування визначають за допомогою йодидкрохмального паперу. Для цього краплю реакційної суміші наносять скляною паличкою на смужку йодидкрохмального паперу і спостерігають за зміною кольору.
Записують спостереження і рівняння реакції (одержаний розчин зберігають в охолоджувальній суміші для подальших дослідів).
8.13. Розкладання солі діазонію
В пробірку наливають 3 мл розчину хлористого фенілдіазонію, одержаного в досліді 5.12 і обережно нагрівають.
Спостерігають за виділенням газу (якого?), записують рівняння реакції.
8.14. Реакція азосполучення
А. Одержання анілінового оранжевого (льодяне фарбування).
Розчиняють 0, 1 г β -нафтолу в 5 мл 10%-го розчину гідрокси-ду натрію і змочують цим розчином смужку бавовняної тканини, обережно висушують її над плиткою. Потім занурюють тканину в охолоджуваний розчин хлористого фенілдіазонію (приблизно 5 - 6 мл), одержаного в досліді 5.12, частину розчину, що залишилася, зберігають для подальшого досліду.
Записують спостереження і рівняння реакцій.
Б. Одержання анілінового жовтого
У пробірку поміщають 0, 5 мл диметиланіліну, 3 - 4 мл води і додають краплями 10%-ну соляну кислоту до утворення розчину солі аніліну. Потім розчин охолоджують, додають 3 - 4 мл розчину хлористого фенілдіазонію (з досліду 5.13) і 2 - 3 мл насиченого розчину ацетату натрію, необхідного для нейтралізації соляної кислоти. Суміш струшують. Записують спостереження і рівняння реакцій.
8.15. Анілін
У круглодонну колбу із зворотним водяним холодильником загружають 200 г (3, 58 моль) залізних стружок, 300 мл води і 20 мл 35%-ної соляної кислоти (0, 2 моль НСl).
Для розтравлення заліза суміш кип’ятять в колбонагрівачі 10 хвилин. Потім до киплячої суміші приливають невеликими порціями через лійку і холодильник 100 мл (0, 98 моль) нітробензолу на протязі 30-40 хвилин, час від часу струшуючи колбу. Через 2 години припиняють нагрівання і додають додатково 100 г заліза і 10 мл соляної кислоти. Нагрівають ще 2 години до закінчення реакції. Після охолодження суміш переносять у колбу для перегонки з водяною парою, а реакційну колбу ополіскують невеликою кількістю води, що підкислена соляною кислотою.
До реакційної маси в колбі для перегонки з водяною парою додають порціями концентрований або твердий NаОН до лужної реакції за індикаторним папером. Далі анілін відганяють з водяною парою(5).
Дистилят насичують NaCl, висолюючи анілін. Одержану суміш переносять в подільну лійку. Нижній шар відокремлюють у колбу, а верхній через верхній тубус подільної лійки зливають у чисту суху колбу. Водний солевий шар знову поміщають у подільну лійку і видаляють анілін двічі етером. Етерні витяжки об’єднують з раніш окремо зібраним аніліном і висушують КОН.
Збирають прилад для перегонки. В суху колбу Вюрца фільтрують висушений етерний розчин аніліну. Потім відганяють етер, нагріваючи перегінну колбу на водяній бані, використовуючи водяний холодильник. Далі змінюють холодильник на повітряний і переганяють анілін при атмосферному тиску (т. кип. 180-185оС) або у вакуумі.
Вихід аніліну становить 90 г.
Примітки.
1. При відсутності перемішування беруть додатково 50% від розрахованої кількості заліза і соляної кислоти.
2. Кінець реакції відновлення визначають за обезбарвленням дистиляту, що стікає із зворотного холодильника.
3. Необхідно спочатку перенести реакційну масу в колбу для перегонки з водяною парою, а потім додавати NаОН, а не навпаки тому, що будуть втрати аніліну.
4. Для зменшення втрат розчин солянокислого аніліну реакційну колбу промивають розчином 5 мл соляної кислоти в 50 мл води.
5. Присутність залишкових кількостей аніліну у дистиляті визначають реакцією з бромною водою (випадає білий осад 2, 4, 6-триброманіліну).
6. Зверніть увагу на засоби техніки безпеки при роботі з діетиловим етером (на робочому столі не повинно бути відкритого вогню!).
8.16. Метилоранж (геліантин)
20 г (0, 116 моль) сульфанілової кислоти розчиняють в 50 мл 2 н. розчину їдкого натру і додають 8 г (0, 115 моль) нітриту натрію в 100 мл води (1, 2). Потім реакційну суміш охолоджують льодом до 0-5оС і приливають 50 мл двонормального розчину соляної кислоти (0, 1 моль HCl). Попередньо готують розчин з 12 г (0, 1 моль) диметиланіліну в 100 мл 1н. розчині соляної кислоти (0, 1 моль HCl), до якого додають приготовлений раніш розчин солі діазонію - натрієву сіль діазобензолсульфокислоти. Після ретельного перемішування розчин приймає червоний колір. Потім до одержаної реакційної суміші приливають розчин їдкого натру до явно лужного середовища, при цьому в осад випадають оранжево-коричневі кристали барвника. Суміш залишають стояти на декілька годин, після чого відсмоктують на лійці Бюхнера і перекристалізують з гарячої води. Вихід кількісний.
|
|
