
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Механизм сопряжения дыхания и фосфорилирования в митохондриях 7 страница
|
|
Образование заменимых аминокислот из промежуточных продуктов распада углеводов. Источником синтеза аминокислот служат пируват, 3-фосфо- глицерат и рибозо-5-фосфат. Первые два — метаболиты гликолиза, третий — метаболит пеитозофосфатного цикла.
Из пирувата образуется аланин двумя путями: 1) трансаминироваиием с участием аланинаминотрансферазы:
Пируват + Глутамат^Ц* Аланин + 2-Оксоглутарат
2) восстановительным аминированием с участием аланиндегидрогеназы (АЛДГ):
Пируват + NH3 + НАД • Н + Н+ +HsOАлании + НАД*
Из 3-фосфоглицерата образуется серии, а из серина — глицин. Поэтому общим предшественником для серина и глицина можно считать 3-фосфогли- церат:
•5-Фосфоглвцерат ——*• З-Фосфосерин __н ^» Серии
Сирин + ТГФК Глицин + Ы6^, 0-Метилен-ТГФК
Из рибозо-5-фосфата образуется гистидин. Первоначально рибозо-5-фос- фат превращается в а-5-фосфорибозил-1-пирофосфат (ФРПФ), который участвует в дальнейших стадиях биосинтеза и гистидина, и пуринов:
Рпбозо-5-фосфат —*■ Фосфорибозиллнрофосфат —*■ Гистидин
Однако возможности биосинтеза гистидина таким способом ограничены, поэтому он является полуэаменнмой аминокислотой.
Синтез заменимых аминокислот из метаболитов цикла Кребса. Источником синтеза аминокислот служат оксалоацетат и 2-оксоглутарат. Из окса- лоацетата образуются аспарагиновая кислота и аспарагин. Первая — путем трансаминирования с участием аспартатаминотрансферазы, а вторая — аминированием с участием аспарагинсинтетазы:
Оксалоацетат + Глутамат^г Аспарагиновая кислота + 2-Оксоглутарат
Аспарагиновая кислота + NH3 + АТФ —Аспарагин + АДФ + Ф„
Из 2-оксоглутарата образуются глутаминовая кислота, глутамии, пролин и в конечном счете гидроксипролин. Синтез глутаминовой кислоты и глутамина протекает с участием соответственно глутаматдегидрогеназы и глута- минсинтетазы. Глутаминовая кислота в ходе обмена превращается й пролин; гидроксипролин образуется только после включения пролина в полипептидную цепь, где он гидроксилируется с участием пролингидроксилазы.
Синтез заменимых аминокислот из незаменимых. Из незаменимой аминокислоты фенилаланина образуется заменимая — тирозин. Этот процесс-ка- тализируется фенилаланингидроксилазой, кофактором которой является ди- гидробиоптерин, а восстановителем — НАДФ • Н2:
Фенилаланин + НАДФ. Н + Н+ + О, —► Тирозин + НАДФ+ + RjO Поскольку фенилаланин — незаменимая кислота, то возможности эндогенного синтеза тирозина ограничены.
Метионин может превращаться в цистеин. Источником серы является сам метионин, а остальная часть молекулы строится за счет серина. В синтезе используется активная форма метионина — S-аденозилметионин. При деметилировании его образуется S-аденозилгомоцистеин, а затем гомоцистеин:
Метионин S-Аденозил метионин S-Аденознлгомоиистенн + ц (J Гомоцистеин + Аденознн Гомоцистеин взаимодействует с серином при участии цистатионинсин- тетазы. При этом образуется цистатионин. На последней, стадии цистатионин расщепляется цистатионазой с выделением свободного цнстеина:
Цистатионин-» 2-Оксобутират + NH, + Цистеин В качестве кофактора цистатионазы выступает пиридоксальфосфат.
Орнитин в тканях млекопитающих превращается в аргинин. Однако эта возможность образования аргинина невелика, поскольку он сам служит субстратом для синтеза мочевины. Поэтому аргинин является полузаменимой аминокислотой. - '
4. Использование аминокислот для образования небелковых азотсодержащих соединений
Аминокислоты широко используются для синтеза многих небелковых азотсодержащих веществ: холина, фосфатидов, креатина, медиаторов (включая биогенные амины), пигментов, витаминов, коферментов, порфиринов, пури- новых и пиримидиновых оснований; в растениях — алкалоидов и прочих продуктов вторичного метаболизма, а в микроорганизмах— антибиотиков.
Биосинтез и распад креатина. В тканях человека и животных креатин синтезируется из трех аминокислот — аргинина, глицина, метионина. Синтез креатина идет в две стадии. На- Первой образуется гуанидинуксусная кислота из аргинина и глицина с участием фермента глицин-амидинотрансфе- разы (в рамку взят переносимый фрагмент):
Г NHa" ' ; .NHj" ' •
: I: ' I: NHj
. С =NH': c-NH- I
" " I. NH, 1 (dH,),
NH I NH +
| + CH, —► I H—C—NH,
(CHa)3 I CH, I
I • COOH 1 COOH
Первая стадия активно протекает в почках и поджелудочной железе.
На второй стадии происходит, метилирование гуанидинуксусной кислоты с участием гуанидйнацетат-метилтрансферазы. Донором метильных групп является активная форма метионина — S-аденозилметионин:
< l=ni
5-адено1илгоыои
Эта стадия протекает в печени и поджелудочной железе, где имеются необходимые условия и соответствующий фермент для синтеза креатина из гуанидинуксусной кислоты. Считается, что синтезированный в печени н поджелудочной железе креатин разносится с кровью к остальным органам и тканям: головному мозгу, скелетным мышцам, сердцу и т. д. Однако в обмене креатина остается еще много неясного. В частности, обнаружено, что в сердце человека и других мышечных тканях содержится наибольшее количество креатина, хотя он в них почти не проникает. В клетках креатин участвует в переносе энергии путем обратимого перефосфорилировання с АТФ (см. раздел «Биоэнергетика»), Одним из продуктов распада креатина является креатин ин, 'который образуется неферментативным путем:
H, N—С—N—СНа—СООН ь J - H N—С—N—СИ, —СО II i I II I ]
NHCH, I NH CH3 |
Примерно 2% креатина, содержащегося в организме, превращается в креатин и н. В плазме крови в небольших количествах имеются креатин и креа- тинин. В почках, печени и поджелудочной железе, синтезирующих креатин, содержание его невелико (0, 1—0, 4 г/кг). Наибольшие количества его в скелетных мышцах (25—55 г/кг), в сердце (15—30 г/кг), в ткани головного мозга (10—15 г/кг).
С мочой выделяется креатин только у детей; у взрослого человека выделяется с мочой креатииин (за сутки около 4, 4—17, 6 ммоль), причем имеется прямая зависимость между развитием мускулатуры человека и выделением креатинина. Если с мочой выделяется креатин, то это свидетельствует о патологии.
Образование и распад медиаторов. Медиаторы образуются в нервной ткани и ряде других клеток. Нейромедиаторы* образующиеся в нервных окончаниях, участвуют в передаче нервного импульса на другие нервные клетки или периферические органы и ткани Тканевые медиаторы участвуют в межтканевой регуляции обмена веществ.
В образовании ряда медиаторов существенное значение имеет реакция декарбоксилирования аминокислот, которая катализируется специфическими ферментами декарбоксилазачн, содержащими в качестве кофермента пири- доксальфосфат:
R-CH-cooh + соа
NH,
аминокислота виогеаный.а«ия
Продуктом декарбоксилирования являются амины, обладающие высокой биологической активностью, поэтому их называют биогенными аминами. Большинство медиаторов принадлежат к этой группе соединений.
Одним из путей обезвреживания1 биогенных аминов является их окислительное дезаминирование с участием аминооксидаз: J>
R—СН2—NH, + 0, + Н, 0 — в-00" " '1'" 1'» R-Cf +NH. + H.O.
чн
Аминооксидазы бывают двух типов: моноаминооксидаза (МАО) и диами- нооксидаза (ДАО). Коферментом МАО служат ФАД, а Д-АО — пиридоксаль- фосфат (для реакции необходимы ионы Сиа+). МАО связана с митохондриями клеток, а ДАО находится в цитоплазме. Небольшие количества этих ферментов присутствуют в крови. МАО ннактивирует первичные, вторичные и третичные амины, а ДАО — преимущественно гистамнн, путресцин, кадаверин и в меньшей степени алифатические амины. Продукты дезаминирования биогенных аминов — альдегиды — окисляются с помощью альдегиддегидроге- наз до органических кислот:.о
Я—Cf + НАД. Н + Н* + HsO-*R—СООН + НАД* Н
Образование гнстамииа. Гистамнн синтезируется из гистидина под действием гистидиндекарбоксилазы:
N—С—СН, —СН—СООН " -«г*- N—C—СН, —СН.
II II I • ~ (I II ' I
НС СН NH, НС СН.NH,
Почти все тка! < и и органы содержат гистамнн. Особенно много его в тканях легких и в коже, имеется он в спинном мозге и подкорковых образованиях головного мозга. Большое количество гйстамина образуется н депонируется в тучных клетках соединительной ткани, в которых он связан в виде белково-гепаринового комплекса. Освобождается он из тучных клеток под действием веществ,.которые называются либераторами гистамнна. Большое количество гнстамина образуется в слизистой желудка, где он действует на секрецию пепсина и соляной кислоты. В крови гистамнн связан с гранулами базофилов и эозинофилов. Небольшие количества его всегда имеются в плазме крови и других биологических жидкостях.
В больших количествах гистамин освобождается при патологических Процессах, являясь медиатором аллергических реакций.
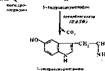
Образование серотонииа. Серотонин образуется из триптофана: f^ Л-СН, —сн—СООН "»у^01б<, нмПНоо.сиг, на„, -----; Г~СНГ" < ГН—" С00Н
kXj к v, 1 UM L,
И 'о. н_п Ч н
|
Примерно 90% серотоннна взрослого человека содержится в -энтерохро- маффинных клетках кишечника. Остальная часть его находится в тучных клетках кожи, селезенке, печенн, почках, легких. Много серотоннна в тромбоцитах крови и в центральной нервной системе. В частности, он образуется в сером веществе коры головного мозга, в гипоталамусе. Серотонин играет роль медиатора в нервной системе и местного регулятора функций периферических органов и тканей.
Образование у-аминомасляиой кислоты (ГАМК). Г AM К образуется нз глутаминовой кислоты под действием глутаматдекарбоксилазы: НООС—CHj—CHj—СН—СООН-—_*Н00С—СНг—CHj—СН, —NHj
Синтез протекает в тормозных синапсах нервной системы, являясь их медиатором. Наибольшие количества ГАМК содержатся в подкорковых образованиях головного мозга (в черной субстанции, бледном шаре, гипоталамусе). В периферических органах она встречается в виде следов.
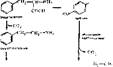
Образование катехоламянов. Катехоламины — группа медиаторов и гормонов, относящихся к биогенным аминам; образуются они из фенилаланина и тирозина (рис. 59)- Из фенилаланина и тирозина образуются следующие биогенные амнны: фенилэтиламин, фенилэтаноламин, ДОФА, дофамин, нор- адреналин и адреналин. Главными из катехоламинов, выполняющих медиа- торные или гормональные функции, являются адреналин и норадреналин. Обнаружены меднаторные свойства у дофамина и, по-видимому, у тирамина. Норадреналин, адреналин синтезируются в хромаффннных клетках мозгового вещества надпочечников (выполняя гормональную функцию), в адренэрги- ческих синапсах головного мозга и в окончаниях симпатических нервов вегетативной нервной системы. Дофамин образуется в синапсах центральной нервной системы (гипоталамус, лимбическая система и др.), сетчатке, симпатических ганглиях, где играет роль медиатора в дофаминэргических синапсах. В небольших количествах дофамин находится в мозговом веществе надпочечников. Много его по сравнению с другими катехоламннамн в печени, легких и кишечнике.
| ■ сн.-ся-чн, „„„ |
| о, нго |
ir*
J2™*
с
Рис. 59. Схема образования катехоламинов ■ лр" < " '" '"
Инактивация адреналина и норадреналина осуществляется двумя путями: с помощью.«олоалшноо/ссцдазбе и катехол-0-метилтрансферазы, т. е. путем дезаминировання и метилирования.
Образование таурина. Таурнн — тоже биогенный амин, образуется из цистеина: '
| Н2С—SOjH И—С—NH, |
| н—с—nhj СООН |
Н2с—SO, H
н3с—s02h Н—С—NH-,
Аоон
и и стеи и сул ьф и н овет
Это соединение синтезируется в различных органах. В печени он используется в реакциях конъюгации с желчными кислотами. В нервной системе, очевидно, является медиатором в синапсах.
| Триптофан- 10-271 |
Образование некоторых витаминов и коферментов из аминокислот. Из триптофана в тканях человека образуется никотинамид (витамин РР):
-Никотиновая кислота-*-Ннкотйнамид
ь
Поэтому триптофан, поступающий с пишей, может частично заменять недостаток никотинамида и пище.
Цистеин используется для биосинтеза коферментов пантотеновой кислоты (витамин Bj) — 4-фосфопантетеина и КоА. Из цнстеина, глутаминовой кислоты и глицина образуется в две стадии глутатион, выполняющий функции кофермента некоторых оксидоредуктаз. На первой.стадии синтеза действует глутаминилцистейясинтетаза, а на второй — глутатионсинтетаза.
Синтез порфиринов н азотистых оснований нуклеотидов, в которых участвуют аминокислоты, целесообразно рассмотреть.специально в главах, посвященных обмену этих веществ.
5. Регуляция обмена аминокислот в оргзяяэме Аминокислотный баланс в -организме человека зависит от полноценности поступающих с пищей белков. Отсутствие одной яз незаменимых аминокислот в пищевом рационе или длительное непоступление полунезаменимых аминокислот приводит к нарушению использования в синтезе белков и других аминокислот (как заменимых, так и незаменимых). Развивается нарушение аминокислотного баланса. В норме процессы потребления аминокислот в биосинтетических процессах сбалансированы с процессами их поступления (гидролиз тканевых белков, синтез заменимых аминокислот). Из клеток а околоклеточную жидкость и кровь аминокислоты выходят свободно, путем простой диффузии. С кровью они разносятся по органам и тканям. Однако поступают они в разные ткани избирательно, особенно в ткань головного мозга. Причина этого во многом неясна. Транспорт аминокислот в клетки разных органов, очевидно, определяется эффективностью отдельных систем, переносчиков дли разных групп аминокислот, В почках происходит реабсорб* ция аминокислот иа мочи в крЫь, что позволяет сохранять их' для организма и лишь небольшое количество аминокислот теряется с мочой.
Одним из факторов, регулирующих обмен аминокислот, яйляется по- ' стулленне их с пищей. Потребление значительного количества белковой • пиши ведет к массивному поступлению аминокислот в' печень, В ней аминокислоты способствуют увеличению активности ферментов, которые вызывают их распад до конечных продуктов обмена- (ферменты дез а минирования аминокислот.и синтеза мочевины). Так. устраняется избыток поступивших в организм аминокислот. При голодании, наоборот, происходит активный распад белков в тканях и образование в них свободных аминокислот.
. Регуляция аминокислотного баланса возможна на этапах транспорта аминокислот через кишечный эпителий (при всасывании), периферические ткани (при проникновении внутрь клеток) и канальцы почек (при реабсорб- цин). Стимулируется мембранный транспорт аминокислот, в основном инсулином. Кроме того, инсулин и другие гормоны способны изменять скорость использования аминокислот в реакциях биосинтеза или скорость распада белков в тканях. Инсулин, соматотропин, тирео'идные гормоны, женские и мужские половые гормоны в физиологических условиях способствуют использованию аминокислот в биосинтезе белков и других синтетических процессах. Глюкокортнкоиды могут ускорять в разных тканях оба процесса: в одних распад белков и образование аминокислот, в других — использование аминокислот в биосинтезе белков.
Поскольку аминокислоты являются главным источником азота для всех азотсодержащих соединений организма, то они определяют состояние азотистого баланса организма, Азотистый баланс—-это разность между количеством азота, получаемого с пищевыми азотсодержащими веществами (преимущественно белки, аминокислоты), и азотом всех азотсодержащих соединений, -теряемых организмом с мочой, фекалиями, потом. Если количество поступающего азота равно количеству теряемого, а организме существует азотистое равновесие. Если количество поступающего азота больше, чем выделяющегося из организма, азотистый баланс положителен. При превышении выделения азота над поступлением азотистый баланс отрицателен. Положительный азотистый баланс бывает при интенсивном синтезе белка из аминокислот (в период развития плода при беременности, в период роста детей, при употреблении большого количества мясной пищи, введении анаболических гормонов и т. д.), Отрицательный азотистый баланс развивается при полном белковом голодании, при длительном сния*ейии двигательной активности, тяжелых хронических заболеваниях, ожосзд й других состояниях, мешающих нормальному перевариванию белков, всасыванию аминокислот и ведущих к распаду тканевого белка.
6. Аминокислоты как лекарственные препараты
В практической медицине применяются препараты гидролнэатоа белков и препараты отдельных аминокислот.
Препараты гидролизатов белков (препараты для парентерального питания) представляют собой смесь аминокислот, полученных путем кислотного или ферментативного гидролиза разных белков. К ним относятся гидроли* зин, гидролизат казенна, аминопептид, церебролиэин, аминокровин, фнбрнно- сол. Эти препараты компенсируют белковое голодание организма, обеспечивают азотистое равновесие и даже положительный азотистый баланс у больных после операций на желудочно-кишечном тракте, с нарушениями переваривания белков и всасывания аминокислот» при тяжелых ожогах.
Препараты отдельных аминокислот, Метионин, а также гндролкзаты, содержащие его в больших количествах, применяются как липотропные факторы и для лечения белковой недостаточности при хронических заболеваниях.
Есть' указания на положительный эффект использования цистеина С" того же метионина, который превращается в организме в цистгнн) при нарушениях обмена серусодержащих белков (хрусталик, роговица глаза, коллаген и т. д.)» при отравлении солями тяжелых металлов, которые связываются аминокислотами,
Широко используются в клинике глутамкновая и аспарагнновая кислоты (последняя в виде калиевых н магниевых солей — препараты «панан- гин», «аспаркам»), которые играют центральную роль в обезвреживании аммиака и в других синтетических реакциях аминокислотного обмена.
В настоящее время разрабатываются препараты различных смесей кристаллических аминокислот, особенно незаменимых, которые в определенных соотношениях будут применяться в чистом виде или в виде добавок к другим лекарственным средствам природного происхождения.
10* 291
ГЛАВА 20. ОБМЕН ГЕМПРОТЕИДОВ
Смешанные макромолекулы — гликопротеиды, липопротеиды — обновляются описанными выше путями. Белковая часть распадается после гидролиза на аминокислоты, а небелковая — по путям превращения соответственно углеводов и липидов.
Характерной особенностью гемпротеидов является обмен небелковой части этих сложных белков. Основную массу (около 83%) гемпротеидов организма составляет гемоглобин, находящийся в эритроцитах крови и клетках костного мозга. Остальное приходится на миоглобин скелетных мышц и сердца (около 17%) и клеточные гемпротеиды — цитохромы, каталаза, пероксидаза и т. д, (менее 1%).
1. Синтез гемпротеидов
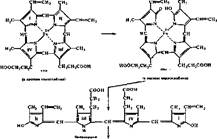
Исходными веществами в синтезе гема служат глицин 'и. сукцииил-КоА (рис. 60). Из них образуется Ь-аминолевуленовая кислота с участием пи- ридоксальзависимого фермента — Ь-аминолевулинатсинтетазы. Затем из двух молекул S-аминолевуленовой кислоты с участием порфобилиногенсинтазы образуется порфобилиноген — прямой предшественник порфиринов. Одним из
2 Сукцинил-КоА
' F
| L, I f С" =и с I / СН, HjN |
| I I рнг --•••С" |
| Протопорфирин IX t — Копропорфириноген Ш |
- Копропорфирин 111
I Схема синтеза г
них является копропорфирин III, который непосредственно превращается в протопорфнрин IX. Включение иона железа в кольцо протопорфнрина IX осуществляется с участием феррохелатазы. На заключительной стадии гем комплексируется с глобином с образованием гемоглобина или миоглобина. При синтезе других гемпротеидов гем соединяется с характерной белковой частью цитохромов и других гемсодержащих ферментов. Если белка недостаточно, чтобы связать образовавшийся гем, то происходит окисление гема кислородом в гемнн, который угнетает первую реакцию синтеза порфири- нов (см. рис. 60).
Ферменты, участвующие в биосинтезе гема, имеются в костном мозге, ядросодержащих эритроцитах, печени, почках, слизистой кишечника. Реакции образования б-амянолевуленовий кислшы идут в митохондриях, образование порфобилиногена и синтез из него копропорфириногена III — в цитоплазме, а синтез гема из копропорфириногена III — опять в митохондриях.
2. Распад гемпротеидов
За сутки в организме человека, распадается около 9 г гемпротеидов, главным образом в результате распада гемоглобина эритроцитов. Эритроциты примерно через 120 дней разрушаются (лизируются) в кровеносном русле или в селезенке. Гемоглобин, освобождающийся из эритроцитов в крови, связывается гаптоглобином (специальный а2-глобулин плазмы) и в виде комплекса гемоглобин — гаптоглобнн попадает в клетки ретикул оэнд отел нал ь- иой системы (РЭС), главным образом селезенки. Гемоглобин окисляется в метгемоглобии (Fe3*), а затем подвергается распаду. При этом гаптоглобнн отщепляется.и переходит в кровь. В клетках РЭС происходит первая фаза распада гемоглобина, сопровождающаяся образованием нз него билирубина:
|

|
| соон |
| соон |
| СН3 СН=СН2 |
бнянсубт-
Сначала под действием гемоксигеназы происходит окислительное расщепление а-метинового мостика гема, соединяющего два соседних пиррольных кольца. Кольцевая структура гема разрывается и образуется вердоело- вин. Последний т.еряет железо, которое связывается белком ^переносчиком траисферином и доставляется с кровью в костный мозг и глобин. Глобин гидролнзуется катепсинами селезенки до аминокислот. Разомкнутая тетра< пиррольная цепь вердоглобина называется биливердином (желчный пигмент зеленого цвета). При восстановлении биливердина образуется билирубин — пигмент красно-желтого цвета,
Билирубин — плохо растворимое в воде соединение, поэтому, поступая в Кровь, он связывается белком плазмы альбумином. Комплекс альбумин — билирубин — важнейшая нормальная транспортная форма желчных пигментов. С током крови билирубин поступает в клетки печени. Как лнпофильное вещество он легко проникает'через мембрану клеток печени, освобождаясь от альбумина.
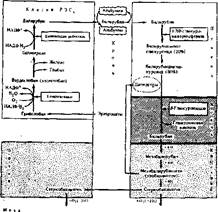
Внутри клеток печени происходит вторая фаза превращения гемпротеидов (рис. 61). В печеНи образуются конъюгированные формы билирубина — билирубинглюкуроииды. Донором Глюку ромовой кислоты выступает УДФ-глю- куройовая кислота. Реакция катализируется УД Ф ^люкуронозилтрансферй- зой. Образуются билнрубннмоноглкжуронид (20%) и билирубинднглюкуро- нид (80%). Били рубин глюкурониды — хорошо растворимые в воде соединения.
Билирубинглюкуроииды лишь в незначительных количествах могут диффундировать в кровеносный капилляр. Поэтому в плазме крови присутствуют две формы билирубина:, неконъюгированный (он же непрямой, или свободный) и конъюгированный (он же прямой, или связанный). На долю первого приходится около 75% общего билирубина плазмы крови, на долю второго — около 25%.
Билирубинглюкуроииды выделяются с желчью в кишечник, где происходит заключительная, третья фаза распада гемпротеидов. В желчных путях отщепляется глюкуроновая кислота от билирубинглюкуронидов и вновь образуется неконъюгированный билирубин. В тонком кишечнике небольшая часть билирубина может всасываться и через портальную вену вновь поступать в печень, а оттуда опять с желчью выделяться из кишечника. Эта. печеночно-кишечная циркуляция, сходная с циркуляцией желчных кислот, возможно, имеет биологическое значение. Большая же масса билирубина подвергается многократному восстановлению бактериями кншёчлика или редуктазами слизистой кишечника. В тонком кишечнике билирубин превращается в мезобилирубин, затем мезобилирубиноген (или уробилиноген). Последний всасывается в тонком кишечнике и через воротную вену поступд-
|
| Рис. 61 |
| Стеркобилми Сгеркобилнк ® Схема распада гемоглобина в тканях организма |
ет в печёнь, где уробилиноген необратимо разрушается до моно- и дйпир- ролов. Неразрушенный уробилиноген вновь поступает с желчью в кишечник. В толстом кишечнике мезобнлирубиноген (уробилиноген) восстанавливается анаэробными бактериями до стеркобилииогена, который, как и уробилиноген, бесцветен. Большая часть стеркобилииогена выделяется с фекалиями и быстро окисляется кислородом воздуха до стеркобилина — оранжево-желтого пигмента, в основном определяющего цвет фекалий.
Небольшие количества стеркобилииогена всасываются в прямой кишке и через систему геморроидальных вен, минуя печень, достигают с током крови почек, которые выводят его с мочой. Стеркобилиноген мочи, как и в фекалиях, окисляется в стеркобилнн, частично определяя нормальный соломенно-желтый Цвет мочи. Ранее сайт ал ось,.что с мочой выделяется-уробилиноген (это нашло отражение в его названии), который окисляется в уробилин, имеющий ту же окраску, что и стеркобилнн. Возможно, сходство в окраске приводило к ошибочным заключениям, хотя по строению уробилин и стеркобилнн отличаются. В норме уробилиноген не выделяется ни с мочой, ни с фекалиями.
Итак, в норме промежуточный продукт распада гема — билирубин — не накапливается в крови, а быстро захватывается клетками печени. По содержанию билирубина и соотношению его форм в крови можно судить, с одной стороны, о скорости распада гемпротеидов в клетках РЭС, а с другой — о превращении билирубина в печени. В норме содержание общего билирубина в сыворотке крови составляет 8—20 мкмоль/л (нз них 75% неконъюги- рованного).
Конечный продукт превращения билирубина — стер коб или ног ен — выделяется у человека в основном с калом (примерно 300 мг в сутки) и в незначительных количествах с мочой (около 1—4 мг в сутки). На состав пигментов, выделяемых с калом и мочой, влияет состояние микрофлоры кишечника. У новорожденных, не имеющих кишечной микрофлоры,, выделяющийся билирубин окисляется до биливердина, окрашивающего кал в зеленоватый цвет (поэтому первородный кал — меконнй—имеет травянистую окраску). У детей первого года жизни по мере заселения кишечника микрофлорой меняется состав выделяемых пигментов и окраска фекалий. Исчезает зеленоватый оттенок кала, вызываемый присутствием биливердина, гак как бактерии кишечника'начинают восстанавливать билирубин до стеркобилииогена.
3, Патология обмена желчных пигментов
Под влиянием различных факторов в организме может нарушаться образование, превращение и выведение билирубина. Повышение содержания билирубина в крови ведет к отложению его в тканях, в том числе в коже и слизистых, и вызывает окрашивание их в коричневато-желтый цвет (цвет билиру бина). Эти состояния называют желтухами, которых бывает несколько видов: гемолитическая (или надпеченочная), паренхиматозная (или гепатоцеллю- лярная) и обтурационная (или подпеченочная).
Гемолитическая желтуха возникает по многим причинам, вызывающим массивный внутрисосудистцй или тканевый (в клетках РЭС) распад эритроцитов. Большое количество неконъюгировакного билирубина, поступающего из клеток РЭС в кровоток, не успевает конъюгироваться в печени, поэтому в крови сохраняется высокий уровень его. Фекалии из-за избытка выделяемого стеркобилина и уробилина интенсивно окрашиваются и становятся почти темного цвета, а в моче содержится много уробилина, окрашивающего мочу в интенсивно оранжево-желтый цвет.
Паренхиматозная желтуха возникает вследствие повреждения клеток печени (вирусами, токсическими гепатотропными соединениями), приводящего к повышению их проницаемости, в том числе и для билирубинглюкуро- иидов, которые в норме мало проникают из печеночной клетки в кровь. Повреждение печеночных клеток снижает захват ими билирубина из крови и интенсивность образования билирубинглюкуронидов в них. Поэтому, несмотря на нормальный гемолиз, повышается (но не так выражение, как при гемолитической желтухе) содержание иеконъюгированного н конъюгироваиного билирубина. Фекалии и моча из-за небольшого количества выделяющихся стеркобилина и уробилина слабо окрашены. Однако в моче появляется не- 2% большое содержание неконъюгированного билирубина; отсутствующего в норме.
|
|