
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Механизм сопряжения дыхания и фосфорилирования в митохондриях 3 страница
|
|
Активный аэробный гликолиз считался даже характерным именно для опухолей, но впоследствии был обнаружен в йекоторых нормальных тканях (например, в сетчатке глаза).
Обычно же оба процесса, производящих энергию, — гликолиз и дыхание — работают согласованно. Клетки млекопитающих способны производить энергии больше, чем это необходимо для жизнедеятельности. Однако производство энергии не самоцель, поэтому образование АТФ путем гликолиза и окислительного фосфорилироваиия в клетках организма подчинено простому принципу: спрос диктует предложение. Энергии производится столько, сколько требуется для потребляющих ее процессов. Как только уровень АТФ в митохондриях и цитоплазме достигает определенного значения, дальнейшее его производство в дыхательной цепи и гликолизе прекращается, т. е. продует (АТФ) регулирует свое образование. Снижение содержания АТФ, сопровождающееся обычно увеличением концентрации АДФ, АМФ и Фя, активирует гликолиз и окислительное фосфорилирование н уровень АТФ восстанавливается.
Энергетические посредники в клетках. Прежде всего необходимо остановиться на энергетических посредниках, которые являются связующим звеном между процессами, поставляющими и потребляющими энергию. Таким универсальным энергетическим посредником'в живых организмах всегда считался АТФ, в фосфатных связях которого аккумулируется энергия, освобождающаяся при распаде веществ, и затем расходуется на различные процессы. Другие нуклеозидтрифосфаты (УТФ, ГТФ, ЦТФ, ТТФ) — всего лишь родственные соединения, к тому же образующиеся из АТФ.
Представление об АТФ как единственной энергетической «валюте», было нарушено в связи с открытием протонного потенциала, возникающего на мембране митохондрий. Оказалось, что протонный потенциал используется не только для синтеза АТФ, т. е. химической работы, но и способен заменить АТФ во многих процессах.
Как уже говорилось, за счет протонного потенциала возможно образование теплоты и обратный транспорт электронов, в результате чего становятся возможными восстановительные синтезы в матриксе митохондрий. Транспорт всех веществ, необходимых для дыхания (органические кислоты) и фосфорилироваиия (АТФ, Фв), и даже отмачивание АТФ из матрикса во вне- митохондрнальное пространство протекают за счет энергии протонного потенциала. Кроме того, транспорт некоторых других веществ и ионов кальция также определяется протонным потенциалом. У жгутиковых бактерий энергия Дцн+ способна использоваться на совершение механической работы. Значит, протонный потенциал может потребляться на совершение химической, осмотической, механической работы и образование теплоты.
Все это позволяет говорить, что в живой клетке два вида энергетических посредников — АТФ и протонный потенциал, которые способны превращаться в другие формы энергии. Располагая обоими посредниками, клетка может использовать как источник энергии в водной среде АТФ (хорошо растворимое в воде вещество), а в гидрофобном слое биологических мембран — протонный потенциал (как электрохимический источник энергии). Не исключено, что ка- лнй-натриевый градиент и, возможно, другие ионные градиенты, создающиеся на клеточной мембране за счет энергии АТФ, можно рассматривать как третий вид энергетических' посредников. Например, энергия калий-натриевого градиента, создаваемого на клеточной мембране К+, 1Ча+-АТФазы, способна использоваться иа синтез АТФ (ионное фосфорилирование), т.е. химическую работу. Активный транспорт аминокислот, глюкозы и некоторых других веществ также обеспечивается энергией калий-натриевого градиента на клеточной мембране.
 Рис. 42. Схема креатинкиназного механизма переноса энергии внутри клетки (по В. А. Саксу н др.)
Рис. 42. Схема креатинкиназного механизма переноса энергии внутри клетки (по В. А. Саксу н др.)
|
| апофвбришы |
| ммтоиицфма |
Перенос энергии внутри клеток. В митохондриях образуются оба энергетических посредника — АТФ и протонный потенциал, а в гиалоплазме (в гликолизе) — только АТФ. Митохондриальный АТФ преодолевает мембранный барьер за счет специальных транспортных белков, обменивающих его иа внешний АДФ. В водной среде АТФ переносится путем диффузии к местам потребления. Есть и другой способ переноса энергии АТФ внутри клеток, который имеет место в мышечных органах (в сердце, в скелетных и гладких мышцах). В этом процессе участвуют креатин и изоферменты креатннкиназы. В митохондриях концевая фосфатная группа от АТФ переносится на креатин (Кр) с помощью митохондриального изофермента креатннкиназы. Образующийся креатинфосфат (КрФ) диффундирует к сократительным элементам цитоплазмы — миофибриллам, где передает свой фосфат на АДФ с помощью цитоплазм этической креатннкиназы. АТФ расходуется на месте на сокращение миофибрилл (рис. 42).
Возможно, что в клетке имеет место кабельный механизм передачи протонного потенциала, подобно тому, как в технике передается на расстояние электрическая энергия. Ми- тохондриальные сети, существующие в клетках, можно сравнить с клеточной электропроводкой, по которой передается электрическая энергия, образующаяся при дыхании. Возможность подобного механизма передачи электричества была показана на цианобактериях. Не исключена его вероятность и в клетках млекопитающих.
Пути потребления энергии. Схематически пути потребления энергии в виде протонного потенциала, образуемого в митохондриях животных клеток при окислении веществ или в хлоропластах растительных клеток при поглощении световой энергии, н АТФ представлены на рис. 43. АТФ, помимо общих с Д(1н+ путей потребления энергии, может расходоваться на образование электрических импульсов в нервных волокнах и на синтез различных химических веществ. Протонный потенциал расходуется иногда на обратный перенос электронов и образование, напрткр, восстановленного НАД или НАДФ.
2. Вещества, влияющие на энергетический обмен в клетках
Многие вещества, среди которых имеются яды и препараты, применяющиеся в лечебных целях, могут изменять энергетику клеток, влияя на образование энергии в ходе гликолиза н окислительного фосфорилирования.
Среди веществ, влияющих на гликолиз, можно выделить активаторы и ингибиторы. Глюкоза и ее фосфорилированные производные — глюкозо-6- фосфат и фруктозо-1, 6-биофосфат, применяемые в медицинской практике, улучшают энергетический обмен в тканях организма, вовлекаясь в гликолиз, а затем в окислительные реакции митохондрий. Ингибиторами гликолиза являются моноиодацетат, фторид натрия или калия, арсенат. Фториды блокируют енонлгндратазу, а моноиодацетат — глицеральдегид-3-фосфатдегид- рогеназу, связывая ее SH-rpyraiy. Арсенат действует как разобщитель окисления и фосфорилирования на стадии превращения глицеральдегид-3-фосфата специфической дегидрогеназой, тем самым ннгибируя дальнейший ход гликолиза.
 Рис. 43. Пути потребления протонного потенциала и АТФ в клетке
Рис. 43. Пути потребления протонного потенциала и АТФ в клетке
|
Обширную группу веществ, влияющих на окислительное фосфорилированиё, можно ни механизму действия разделить на четыре группы: I) ингибиторы дегидрогеназ; 2) ингибиторы дыхания; 3) разобщители окислительного фосфорилирования; 4) ингибиторы фосфорилирования. 246
s—H, S—H, «-ФАЛ-Н,
1 jt J
НАД-Нг-»-< 1> П-»- FeS—ПР, 1 KoQ— b —- FeS—II l\—»
О
АТФ If
Рис. 44. Схема действия ингибиторов дыхания (по Метцлеру)
Ингибиторы дегндрогеназ препятствуют окислению субстратов и снижают поступление водорода в дыхательную цепь. Среди нйх можно назвать различные производные НАД, гидразиды нзоникотиновой кислоты (противотуберкулезные препараты ГИНК, фтивазид и др.), являющиеся конкурентными ингибиторами НАД-зависимых дегндрогеназ. Арсенаты н ионы тяжелых металлов блокируют тиоловые группы дегндрогеназ, окисляющих субстраты (например, пнруватдегндрогеназы, сукцинатдегидрогеназы и т. д.). Мало- нат — конкурентный ингибитор сукцинатдегидрогеназы. Смесь ингибиторов НАД- и ФАД-зависимых дегидрогейаз может значительно угнетать дыхание, не влияя на образование протонного.потенциала.
Ингибиторы дыхания блокируют одно из трех звеньев образования протонного потенциала, прерывая поток электронов на участках дыхательной цепи (рис. 44). Первая группа, препаратов блокирует первое звено сопряжения на участке между железосерным белком-1 и KoQ. К этим препа- паратам относятся амитал, или барбамил (снотворный препарат барбитурового ряда), ротенон (рыбный яд), прогестерон (женский половой гормон). Эти вещества прерывают поступление водорода на дыхательную цепь от субстратов', окисляющихся через НАД-зависимые дегидрогеназы, но не ^мешают использованию субстратов, окисляющихся через ФАД (например, сукцината). Выключается также первое из трех звеньев фосфорилирования.
Вторая группа ингибиторов дыхания, к которым относится аити- мицин А (антибиотик, выделенный из стрептомицетов), блокирует дыхательную цепь.на уровне второго звена сопряжения (образования протонного потенциала) и выводит из строя участок цепи до блока. Дыхание возможно только при поступлении электронов и протонов на участок цепи после блока, т.е. на цитохромы с,, е. Например, аскорбиновая кислота является тем веществом, которое окисляется цитохроном с. Поэтому в ее присутствий дыхание в митохондриях продолжается даже несмотря на то, " fro дыхательная цепь «отравлена» антнмнцнном А.
Третья группа ингибиторов дыхания, к которым относятся Цианиды (например, NaCN, KCN), азиды (NaN3), оксид углерода (II), блокирует цнтохромоксидазу и делает невозможным сам процесс дыхания. Эти вещества вызывают ситуацию кислородного голода для дыхательной цепи митохондрий, хотя кислород находится в изобилии. Полное прекращение дыхания, вызванное этой группой препаратов, выключает образование протонного потенциала и связанного с ним фосфорилирования. Наступает энергетический «голод», а с ним и прекращение жизнедеятельности клеток. Поэтому ингибиторы цнто- хромоксидазы являются сильнейшими ядами, отравление которыми вызывает быструю гибель организма.
Разобщители окислительного фосфорилироваиия — обширная группа веществ, влияющих на сопрягающее звено между дыханием и фосфорилиро- ванием, т. е. на протонный потенциал. Однако разобщители никоим образом не влияют на создание протонного потенциала. Они лишь способствуют его расходованию в обход АТФ-синтетазы — основного потребителя энергии протонов для образования АТФ.
Механизм действия разобщителей заключается в том, что они являются переносчиками катионов (протонов или других ионов) через мембрану. Этим они вызывают своеобразное «короткое замыкание» между разнозаряженнымв поверхностями митохондриальной мембраны, переводя энергию мембранного потенциала (дц>) или разности концентраций ионов Н 1 (ДрН) в теплоту. Иначе говоря, разобщители в той или иной степени отключают фосфорилирование от дыхания. При их действии дыхание усиливается, а фосфорилирование подавляется. Все разобщители относятся к мембранотропным веществам..Они делятся на протонофоры и прочие ионофоры.
Лротонофоры способствуют переносу через мембрану протонов, выравнивая их концентрацию и разность зарядов по обе стороны мембраны. Протонофоры в соответствующих концентрациях могут полностью разобщать дыхание и фосфорилирование, так как ликвидируют оба компонента протонного потенциала (Дф и ДрН), созданного дыханием. Фосфорилирующее окисление полностью переходит на свободное, и митохондрии начинают выполнять роЛь «нагревательного прибора» в клетках.
К разобщителям этого типа относятся природные вещества — свободные жирные кислоты, которые в форме аниона (R—СОО-) связывают протоны на внешней стороне мембраны, переносят их в недиссоциированной форме (R—СООН) и затем, диссоциируя, отдают протон на внутренней стороне мембраны (R—COOH-*-R—СОО~ + Н+). Разобщают дыхание и синтез АТФ такие вещества-протонофоры, как 2, 4-динитрофенол, пер фтор пин акол, производные бензимидазола и фенилгидразона, а также ряд лекарственных препаратов — салицилаты (противовоспалительные средства), дикумарол и фе- нилин (оба препарата относятся к противосвертывающим средствам непрямого действия) и т. д. Разобщающие свойства проявляют гормоны щитовидной железы — тироксин и трииодтиронин, которые применяются и как препараты.
Все протонофоры-разобщители липофильны и содержат в молекуле легко отщепляемый протон. Протонофоры, как и другие ионофоры, понижают сопротивление искусственных липидных мембран, помещенных в водную среду, за счет увеличения их проводимости для протонов. Чем сильнее понижается сопротивление, тем сильнее разобщитель.
Ионофоры увеличивают проводимость мембран или одновременно для протонов н других катионов, или только для какого-нибудь одного катиона (например, Na+ или К+)- Механизм действия ионофоров на окислительное фосфорилирование можно рассмотреть на примере действия полипептидных антибиотиков — валиномнцнна, нигерицина, грамицидина А. Валиномицин представляет собой циклическую молекулу (состоит из неполярных аминокислот), растворимую в липидах. Его связывающие группы как бы смотрят наружу, а молекула напоминает форму раскрытого тюльпана, Валиномицин 238 избирательно связывает К+. при этом молекула принимает форму «бутона», в центре которого спрятан ион К+. В таком виде К+ легко пересекает любую мембрану. Перенос К+- валиномнцином из внешней среды внутрь митохондрий полностью компенсирует разность зарядов (электрический потенциал) на мембране, но не ликвидирует избыток Н+ во внешней среде, т. е. ДрН, так как переносит не Н+, а К+- Поэтому валиномицин вызывает сильное (на величину Дф), но не полное разобщение дыхания и фосфорилироваиия.
- Другой антибиотик — нигерицин — устроен таким образом, что переносит также ион К+, но только в обмен на протоны. Ои устраняет, выравнивает разницу концентраций ионов Н+ между внутренней средой митохондрий, где их недостаток, и внешней, где их избыток, т. е. устраняет ДрН, не влияя на электрический потенциал. Разобщающий эффект нигерицина слабее, чем валйномицина, так как ДрН составляет лишь ; /s протонного потенциала. Полностью разобщить дыхание и фосфорилирование можно с помощью одновременного применения обоих ионофоров: валиномицина и нигерицина.
Грамицидин А, полипептидный скелет которого состоит из неполярных аминокислот, образует в мембране канал, состоящий из двух спиральных молекул антибиотика. По этому каналу проникают положительно заряженные ноны Н+, К+, Na+. Грамицидин А снимает протонный потенциал и разобщает дыхание и фосфорилирование.
Антибиотики-ионофоры выравнивают естественные ионные градиенты на любой, а не только на митохондриальной мембране. В частности, они могут снижать разность концентраций ионов К+ и Na+ на клеточной мембране и нарушать жизнедеятельность клеток. У аэробных микроорганизмов ферменты дыхательной цепи и фосфорилироваиия находятся в клеточной мембране, поэтому антибиотики-ионофоры, прекращая выработку энергии и выравнивая 'ионные градиенты между внутри- и внеклеточной средой, вызывают быструю гибель микроорганизмов.
Ингибиторы фосфорилирование действуют на АТФ-сннтетазу, препятствуя использованию протонного потенциала для синтеза АТФ. К этим веществам относятся, например, дициклокарбодиимид (ДЦКД) и олигомицин. ДЦКД блокирует просачивание протонов по F0, т. е. как бы «запечатывает» протонный канал Н*-АТФ-синтетазы. Поэтому фосфорилирование становится невозможным. Поскольку в физиологических условиях оно сопряжено с дыханием, то постепенно дыхание затухает, так как протонный потенциал, созданный дыханием, не используется на фосфорилирование, а расходуется на обращение потока электронов в дыхательной цепи.
Антибиотик олигомицин связывается с белковой субъединицей Н+-АТФ- синтетазы в месте соединения F0 с F,. Тем самым он запечатывает выход канвла и прекращает поступление протонов к F,. одновременно иигибируя синтез АТФ в активном центре F,. Олигомицин полностью останавливает фосфорилирование, что ведет, как в случае с ДЦКД, к остановке дыхания. Нетрудно догадаться, что протонофоры снимают угнетающее действие ингибиторов фосфорилироваиия на дыхание, хотя фосфорилирование остается подавленным.
ГЛАЗА 2в. ОБРАЗОВАНИЕ ЭНЕРГИИ Б ФОТОСИНТЕЭЙРУГОШИХ ОРГАНИЗМАХ
Фотосинтезирующие организмы (фотоавтотрофы) преобразуют световую энергию в химическую и используют ее для синтеза углеводов и других веществ. Фотосинтезирующие клетки имеют аппарат для улавливания и трансформации энергии и ферментные системы усвоения С02. Фотосинтезирующие организмы многообразны. К ним относятся многоклеточные организмы (высшие зеленые растения и низшие их формы — зеленые, бурые и красные водоросли) и одноклеточные (эвгленовые, динофлагелляты и диатомовые водоросли). Большую группч гоотосин^езнруюших организмов составляют прокариоты — сине-зеленые водоросли, зеленые ч пурпурные бактерии. Примерно половика работы по фотосинтезу на Земле осуществляется высшими зелеными растениями, а остальная половина — главным образом одноклеточными водорослями.
I. Фотосинтезирующие структуры
У бактерий фотосинтезирующие структуры представлены в виде впячивания клеточной мембраны, образуя пластинчатые органоиды мезосомы. Изолированные мезосомы, получаемые при разрушении бактерий, называются хрома- тофорами, в ннх сосредоточен светочувствительный аппарат. У эукариотов фотосинтетический аппарат расположен в специальных внутриклеточных органоидах — хлоропластах. Хлоропласта, подобно митохондриям, содержат также ДНК, РНК и аппарат для синтеза белка, т. е. обладают потенциальной способностью к самовоспроизведению. По размерам хлоропласта в несколько раз больше митохондрий. Число хлоропластов колеблется от одного у водорослей до 40 на клетку у высших растений. В клетках зеленых растений помимо хлоропластов имеются и митохондрии, которые используются для образования энергии в ночное время за счет дыхания, как в гетеротрофных клетках.
Хлоро.пласты имеют шаровидную или уплощенную форму. Они окружены двумя мембранами — наружной и внутренней (рис. 45). Внутренняя мембрана укладывается в виде стопок уплощенных пузырьковидных дисков. Эта стопка называется граной. В водорослях находится не более одной граны в каждом хлоропласте, а в высших растениях — до 50 гран, которые соединены между собой мембранными Перемычками. Водная среда между гранами — это строма хлоропласта. Пузырьковидные структуры, из которых состоит грана, называются тилактоидами. В гране от 10 до 20 тилактоидов.
 Рис. 45 Схема ультраструктуры хлоропласта (по Уайту и др.)
Рис. 45 Схема ультраструктуры хлоропласта (по Уайту и др.)
|
Элементарная структурная и функциональная фото синтетически и единица мембран тилактоидов, содержащая необходимые светоуланливаюЩие пигменты и
компоненты аппарата трансформации энергии, называется квантосомой. Эта частииа имеет массу порядка 2 • 106 дальтон и размеры около 17, 5 нм.
2. Стадии фотосинтеза
Фотосинтез — это процесс преобразования лучистой энергии в химическую с использованием последней в синтезе углеводов из углекислого газа. Суммарное уравнение фотосинтеза:
6С02 + 12Н, 0 -^-СвН, 206 + 6Н20 + 602 + 2& 61 кДж/моль Процесс этот эндергонический и требует значительного количества энергии Поэтому суммарный процесс фотосинтеза складывается из двух стадий, которые принято называть световой (или энергетической) и темповой (или метаболической). В хлоропласте эти стадии пространственно разобщены — световая осуществляется в квантосомах мембран тилактоидов, а темновая — вне тилактоидов, в водной среде стромы. Взаимосвязь между световой и темновой стадиями можно выразить схемой
*---, 6 н, о
1 >
6 COj—т С6Н]2Оь
12 Н20 6 Оз 12 НАДФ'Н+Н +-
V V_____ /
/%
Сеет 18 АТФ
Световая стадия протекает на свету. Энергия света трансформируется на-этой стадии в химическую энергию АТФ, а бедные энергией электроны воды переходят в богатые энергией электроны НАДФ • Н2- Побочным веществом, образующимся в ходе световой стадии, является кислород. Богатые энергией продукты световой стадии АТФ и НАДФ • Н2 используются в следующей стадии, которая может проходить в темноте. В темновой стадии наблюдается восстановительный синтез глюкозы из СОг. Без световой стадии темновая невозможна.
Механизм световой (фотохимической)
стадии фотосинтеза
В мембранах тилактоидов имеются два фотохимических центра, или фотосистемы, которыё обозначаются как фотосистемы I и II (рис. 46). Каждая из фотосистем не может заменить друг друга, ибо функции их различны В состав фотосистем входят различные пигменты: зеленые — хлорофиллы а и Ь, желтые — каротиноиды и красные или синие — фикобилины. Фотохимически активен среди этого комплекса пигментов только хлорофилл а. Остальные пигменты играют вспомогательную роль, являясь лишь собирателями световых квантов (своеобразные светособирающие линзы) и проводниками их к фотохимическому центру..Функцию фотохимических центров выполняют особые формы хлорофилла с, а именно: в фотосистеме I —пигмент 700 (Р700) > погло- щаюший свет с длиной волны около 700 нм, в фотосистеме II — пигмент 680 (Р680), поглощающий свет с длиной волны 680 нм. На 300—400 молекул светособирающих пигментов в фотосистемах I и II приходится только одна молекула фотохимически активного пигмента — хлорофилла а. Поглощение световых квантов фотосистемой I переводит яигмент Р700 из основного состоя-
Циклический перенос электронов
 Рнс. 46. Схема циклического я нециклического перекоса электронов между фотосистемами I и II (по Уайту и др.)
Рнс. 46. Схема циклического я нециклического перекоса электронов между фотосистемами I и II (по Уайту и др.)
|
ния в возбужденное — PJqq, в котором он легко теряет электрон. Потеря электрона вызывает образование электронной дырки в виде Р^ по схеме
Электронная дырка способна легко заполняться электроном.
Итак, поглощение световых квантов фотосистемой I приводит к разделению зарядов: положительного в виде электронной дырки (Р^5) н отрицательно заряженного электрона, который сначала акцептируется специальными железосерными белками (FeS-цвнтр), а затем или транспортируется но одной из цепей переносчиков обратно к Р^®, заполняя электронную дырку, или по другой цепи переносчиков через ферредоксин н флавопротеид к постоянному акцептору — НАДФ • Н2. В первом случае происходит замкнутый циклический транспорт электронна во втором —нециклический. Возвращение возбужденных электронов на Рт связано с освобождением энергии (при переходе с высокого на низкий энергетический уровень), которая аккумулируется-в фосфатных связях АТФ. Этот процесс называется фотофосфорилированием; при циклическом переносе происходит циклическое фотофосфорилирование, при нециклическом — соответственно нециклическое. В тнлактоидах идут оба процесса, хотя второй более сложный. Он сопряжен с работой.фотосистемы И.
Поглощение световых квантов фотосистемой Н вызывает разложение (фотоокисленне) воды в фотохимическом центре Рш'по схеме н, о —2Н+ +• ы + 7so,
Фотолиз воды называется реакцией Хилла. Электроны, образующиеся при разложении воды, первоначально акцептируются веществом, обозначаемым Q (иногда его называют цитохромом С56о по максимуму поглощения, хотя оно не является цитохромом). Затем от вещества Q через цепь переносчиков, похожую по составу на митохондриальную, электроны направляются к заполняя электронную дырку.
Следовательно, утраченные P^qq электроны восполняются за счет электронов воды, разлагаемой под действием света в фотосистеме II. Нециклический поток электронов от НгО к НАДФ • Н2, происходящий при взаимодействии двух фотосистем и связывающих их электронно-транспортных цепей, наблюдается вопреки значениям редокс-потенциалов: Е° для /г02/Н20 = +0, 81 В. а Е° для НАДФ/НАДФ • Н= —0, 32 В. Энергия света обращает поток электронов «вспять». Существенно то, что при переносе от фотосистемы II к фотосистеме I часть энергии электронов аккумулируется в виде протонного потенциала на мембране тилактоидов, а затем в энергию АТФ.
Механизм образования протонного потенциала в цепи переноса электронов и его использование на образование АТФ в хлоропластах сходен с таковым в митохондриях. Однако в механизме фотофосфорилирования имеются некоторые особенности. Тилактоиды представляют собой как бы вывернутые наизнанку митохондрии, поэтому направление переноса электронов и протонов через мембрану противоположно направлению его в митохондриальной мембране (рис. 47). Электроны движутся к внешней стороне, а протоны концентрируются внутри тнлактоидного матрикса. Матрикс заряжается положительно, а внешняя мембрана тилактоида — отрицательно, т. е. направление
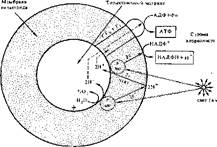 Рис. 47. Схема фотофосфорилирования в тилактондах хлоролластов (ПХ — олас- тохинои)
Рис. 47. Схема фотофосфорилирования в тилактондах хлоролластов (ПХ — олас- тохинои)
|
протонного градиента противоположно направлению его в митохондриях. Другой особенностью является значительно большая доля рН в протонном потенциале по сравнению с митохондриями. Тилактоидный матрикс сильно закисляется, поэтому ДрН может достигать 0, 1—0, 2 В, в то время как Дф составляет около 0, 1 В. Общее значение Дцн*> 0, 25 В.
Н+-АТФ-синтетаза, обозначаемая в хлоропластах как комплекс «CFj + F0», ориентирована тоже в противоположном направлении. Головка ее (F,) смотрит наружу, в сторону стромы хлоропласта. Протоны выталкиваются через CF0+F, из матрикса наружу, и в активном центре F, образуется АТФ за счет энергии протонного потенциала.
В отличие от митохондриальной цепи в тилактоидной имеется, по-видимому. только пвя участка сопряжения, поэтому ня синтез одной молекулы АТФ требуется вместо двух три протона, т.е. соотношение 3 Н+/1 моль АТФ.
Механизм темновой стадии фотосинтеза
Продукты световой стадии АТФ и НАДФ • Н2, находящиеся в строме хлоропласта, используются здесь же для синтеза глюкозы из С02. Ассимиляция диоксида углерода (фотохимическое карбоксилирование) представляет собой циклический процесс, который называется также лентозофосфатным фотоснн- тетнческим циклом или циклом Кальвина (рис. 48). В нем можно выделить три основные фазы: 1
1) фиксация С02 рибулозодифосфатом;
2) образование триозофосфатов при восстановлении З-фосфогЛицерата;
3) регенерация рибулозодифосфата.
Фиксация С02 рибулозодифосфатом катализируется ферментом рибуло- зодифосфаткорбоксилазой:
Рнбулозоди фосфат + С02 ► З-Фосфоглицерат
Далее 3-фосфоглицерат восстанавливается с помощью НАДФ • Hj и АТФ до глицеральдегнд-3-фосфата. Эта реакция катализируется ферментом — глице-
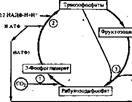 Рис. 46. Схема фотосиктетического цикла образования углеводов (цикл Кальвина)
Рис. 46. Схема фотосиктетического цикла образования углеводов (цикл Кальвина)
|
 Глюко зо-6-фосфат
Глюко зо-6-фосфат
|
| Л |
| tt |
 Попнсахариды
Попнсахариды
|
| I |
ральдегид-3-фосфат-дегидрогенаэой. Глицеральдегид-З-фосфат легко изоме- рнзуется в дигидрокснацетонфосфат. Оба триозофосфата используются в образовании фруктозобисфосфата (обратная реакция, катализируемая фрукто- зобисфосфат-альдолазой). Часть молекул образовавшегося фруктозобисфосфата участвует вместе с триозофосфатами в регенерации рибулозодифосфата (замыкают цикл), а другая часть используется для запасания углеводов в фо- тосинтезирующих клетках, как показано на схеме.
Подсчитано, что для синтеза одной молекулы глюкозы из С02 в цикле Кальвина требуется 12 НАДФ • Н + Н+ и 18 АТФ (12 молекул АТФ расходуются иа восстановление 3-фосфоглицерата, а 6 молекул — в реакциях регенера ции рибулозодифосфата). Минимальное соотношение — 3 АТФ г 2 НАДФ»Н2 Можно заметить общность принципов, лежащих в основе фотосинтетиче ского н окислительного фосфорилироваиия, причем фотофосфор илирование представляет собой как бы обращенное.окислительное фосфорилирование
АТФ и о,
SH, д.» ^ * if окислительное
2 2 М^ фосфорилирование
~С/. О,
Энергия света является движущей силой фосфорилироваиия и синтеза органических веществ (S-H2) при фотосинтезе и, наоборот, энергия окисления органических веществ — при окислительном фосфорилировании. Поэтому именно растения обеспечивают жизнь животным и другим гетеротрофным организмам:
н2о
Свет—1
животные
Углеводы, образующиеся при фотосинтезе, служат для построения углеродных скелетов многочисленных органических веществ растений. Азоторгани- ческие вещества усваиваются фотосинтезирующими организмами путем восстановления неорганических нитратов или атмосферного азота, а сера — восстановлением сульфатов до сульфгидрильных групп аминокислот. Фотосинтез в конечном итоге обеспечивает построение не только обязательных для жизни белков, нуклеиновых кислот, углеводов, липидов, кофакторов, но и многочисленных продуктов вторичного синтеза, являющихся ценными лекарственными веществами (алкалоиды, флавоноиды, полифенолы, терпены, стероиды, органические кислоты и т.д.).
|
|