
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Я. Генная инженерия
|
|
Генная инженерия —- это направление в молекулярной генетике по разработке методов конструирования нужных генов и внедрению их в клетку хозяина с целью изменения ее генетических свойств,
В настоящее время методы генной инженерии используются для генетического конструирования видов, т. е, соединения генов разных организмов (вируса и бактерии, вируса и эукарнотов), направленного улучшения наследственных качеств организма (селекция), промышленного получения белков, являющихся продуктом действия пересаженных в клетку генов и т. д.
Методы генной инженерии включают следующие основные стадии:
1) получение интересующего гена, т. е. фрагмента ДНК;
2) соединение этого гена с так называемой векторной молекулой, способной доставить ген в клетку хозяина и тем обеспечить репликацию чужеродного гена;
3) введение полученной гибридной ДНК в клетку реципиента;
4) отбор клеток, где размножается (клонируется) введенный чужеродный ген.
Получение интересующего гена. Получают требуемые гены или химическим, или ферментативным способом. Прямой химический синтез геиа можно провести, если известна последовательность в нем нуклеотидов. Успехи химии позволяют получить подобным способом ген практически любой длины. Во втором случае предварительно или выделяют в очищенном виде мРНК из тканей (так получены мРНК глобина, овальбумина, иммуноглобулинов и т. д,)^ или синтезируют химическим путем нужную мРНК. Далее МРНК используют как матрицу для ферментативного, синтеза комплементарной ДНК (кДНК) с помощью обратной транскрипции. Для этой цели используется РНК-зависимая ДНК-полимераэа, или обратная транскрнптаза, Сначала с помощью обратной траскрнптаэы на мРНК образуется однонитевая кДНК, а затем с помощью ДНК-полимеразы достраивается вторая нить кДНК-
Получение гибридной ДНК. Вектором называется часть гибридной ДНК. обеспечивающая проникновение и репликацию ее в клетке-хозяине. В качестве вектора применяются плазмиды, умеренные фагн, вирусы. Гибридную ДНК получают путем разрезания молекулы вектора специальными ферментами (рестриктазамн) и соединения его с чужеродным геном с помощью ДНК-лнгазы, '
Перенос гибридной ДНК и клонирование генов. После получения гиб ридной ДНК ее вносят в среду, где находятся клетки-реципиенты. Наиболее частым объектом является кишечная палочка. Для улучшения проникновения гибридной ДНК в клетки их обрабатывают различными способами (например, растворами СаС1г). Клетки, в которых начинается размножение генов, транскрибирование и транслирование, отбираются. Индикатором функционирования пересаженного гена является соответствующий белок. Значительная часть этих белков выделяется во внеклеточную среду, их легко можно получить, например, осадив клетки центрифугированием. Подобными методами была осуществлена пересадка многих генов, в том числе гена инсулина, соматотропина, овальбумина и др. Это открывает возможность промышленного получения белковых лекарственных препаратов генноинженерным методом.
ГЛАВА 24. РЕГУЛЯЦИЯ БИОСИНТЕЗА БЕЛКОВ
Белки определяют жизнедеятельность клетки. Поэтому клетка должна тонко регулировать не -синтез белков вообще, а необходимого в данный момент ассортимента белков.
Белки, которые синтезируются с постоянной скоростью, называются конститутивными, а синтезирующиеся с резко изменяющейся в зависимости от разных условий скоростью — адаптивными или индуцибельными. Конститутивные белки (в том числе и ферменты) содержатся в клетках примерно в постоянных количествах независимо от того, есть ли в них потребность. Количество молекул индуцибельных (адаптивных) белков варьирует в больших пределах. Очевидно, что- синтез конститутивных белков не регулируется, а индуцибельных, напротив, подвержен тонкой регулировке.
Если регуляция на уровне фермента может изменять только функциональные возможности еамого фермента (интенсивна по своей природе), то регуляция синтеза белков (переноса генетической информации) изменяет количество молекул данных белков (или ферментов) и является экстенсивной.
Стимуляция биосинтеза белков, сопровождающаяся увеличением их количества, называется индукцией, а подавление синтеза белков — репрессией. Очевидно, в клетках имеются вещества, сигнализирующие о состоянии метаболизма внутри клетки или в организме. Это позволяет включать или выключать синтез белков. Такими веществами у прокариотов могут быть поступающие в клетку питательные вещества, метаболиты и некоторые внутриклеточные регуляторы (типа циклических нуклеотидов). У многоклеточных, особенно сложноорганизованных, помимо автономных внутриклеточных регуляторов значительное место занимают внеклеточные регуляторы синтеза белков, которые подчиняют деятельность генетического аппарата биосинтеза белков конкретной клетки ткани или органа задачам целого организма.
I. Регуляция биосинтеза белков у прокариотов
Впервые схема регуляции биосинтеза белков у микроорганизмов была предложена французскими учеными Жакобом и Моно в 1961 г. Она была разработана на примере работы лактозного оперона у кишечной палочки.
В принципе регулировать синтез белков можно, контролируя активность разных транскриптонов (оперонов) у бактерий. Механизм этой регуляции 320
г
О S| S> S-, г
II —
Ксщяилф DI'" 0'
О Si S; S,
г "; т
£
Hi) '. Il
t „s
©00
V
Инлукгор PunpecLOp Нгзк-щцяь
6e.ua (по Жакобу и Моно)
выглядит следующим образом. В бактериях имеется группа белков, называемых репрессорами, которые контролируют транскрипцию ра-игых оперонов Участок ДНК, определяющий структуру репрессоров, назван ген-регулятором или цистрон-регулятором. Он может быть расположен не'рядом с промотором, а совсем в другом участке хромосомной ДНК бактерии.
| Рис. 70 Регуля!. |
Все репрессоры связываются с оператором оперона и блокируют трано- крииции определенных мРНК, а с ними и возможность синтеза соответствующих белков. Способность связываться с оператором зависит от конфор- мации репрессора, которая может быть активной или неактивной Только в активной форме репрессор способен образовывать слабые связи с операто ■ 1—271 321
ром и блокировать синтез мРНК и белка, в неактивной форме он не может соединяться с оператором. Вещества, которые инактивируют репрессор, называются индукторами, а вещества, переводящие его из неактивного состояния в активное, — корепрессорами. Следовательно, репрессор имеет участки связывания корепрессора н индуктора. Корепрессорами и индукторами являются питательные вещества, конечные продукты обмена и т. д., которые через репрессор сигнализируют о необходимости увеличить или ослабить синтез белков в клетке.
Механизм индукции рассмотрим на примере регуляции транскрипции лактозного оперона (рис. 70), который несет информацию о структуре трех ферментов (fJ-галактозидазы, p-галактозидпермеазы и р-галактозндацетила- зи), участвующих в превращении пякточы Лактоза, поступающая в клетки, является индуктором. Она связывается с репрессором лактозного оперона и переводит его в неактивную форму, не способную связываться с оператором. Благодаря этому репрессор, который при связывании с оператором частично закрывает примыкающий участок промотора, не мешает присоединению РНК- полимеразы к промотору, ' а следоватёльнб, и транскрипции. Рёпрессоры являются примером отрицательных регуляторов транскрипции и синтеза белка. Однако в отсутствие репрессора нужны положительные регуляторы, помогающие РНК-полнмеразе связаться с промотором и запустить транскрипцию. Эту роль положительного регулятора лактозного оперона (и других оперонов, регулирующих катаболизм глюкозы) выполняет цАМФ. цАМФ связывается со специальным белком, называемым белком — активатором ка- таболитноео гена (сокращенно: БАК).. 'Комплекс цАМФ —БАК присоединяется к промотору рядок" с местом'^сёязывзния' ЙНК-полимеразы и облёгчает ей начало транскрипции структурных.генов. Рибосомы тут же связываются с мРНК и синтезируют три ферментных белка, необходимых для катаболизма лактозы. К этому можно добавить, 'что индукция синтеза белка сопутствует любым ситуациям, при которых количество цАМФ в клетке будет повышаться.
Механизм репрессии. Расщепление ферментами лактозы снижает ее концентрацию и приводит к образованию глюкозы. При распаде глюкозы образуется какой-то метаболит, который угнетает образование цАМФ из АТФ. Дефицит цАМФ снижает связывание БАК, что затрудняет присоединение РНК-полиме- разы с промотором. Полное исчерпание лактозы в среде снижает ее действие на репрессор. Он становится активным, связывается с оператором и блокирует-транскрипцию. Синтез белков останавливается (см. рис. 70).
Другие опероны отвечают не только на отрицательные (репрессоры), но и на положительные (типа цАМФ—БАК) регуляторы. Характерной особенностью бактерий является очень короткое время жизни мРНК (они быстро разрушаются), что дает возможность им быстро приспосабливать свой набор белков к резким изменениям внешней среды (условия питания, действие химических и физических факторов).
2. Регуляция синтеза белков у эукариотов
Механизм регуляции синтеза белка у эукариотов, особенно высших, менее изучен, чем у прокариотов. У высших животных и растений хроматин, организованный в хромосомы, - устроен значительно сложнее, чем у бактерий.
К тому же локализация хроматина в ядре, окруженном ядерной мембраной, значительно усложняет процесс передачи генетической информации, транскрибированной с определенных генов хромосом, в цитоплазму, где происходит синтез белка. Усложнена и обратная связь — влияние метаболитов и прочих химических регуляторов цитоплазмы на активность генов (что легко осуществляется у бактерий). У высших эукариотов не найдено регуляторных белков типа репрессоров бактерий, которые сочетают в себе функции распознавателя химических сигналов метаболизма (специфически связывают свои метаболиты) и регулятора транскрипции оперонов.
Очевидно, в клетках высших организмов стало трудно сочетать эти обязанности, особенно при наличии барьера в виде ядерной мембраны, поэтому сформировались две группы специальных белков. Вероятно, по одну сторону барьера — в цитоплазме — формировалась группа специальных белков, реагирующих на химические регуляторы и йесущих «сведения» об изменениях метаболизма в ядро, а по другую сторону ядерной мембраны — в хромосомах ядра — регуляторы транскрипции генов. Это, видимо, привело •к разделение.функций регуляторных белков (а возможно, и других биомолекул). Одни из них выполняют функцию регуляторов транскрипции генов хроматина и.локализованы в ядре, а другие реагируют на изменения метаболизма в цитоплазме и несут «сведения» об этих изменениях в ядро, где взаимодействуют с белками—регуляторами транскрипции.
Регуляторы активности генов
Как известно, в, организации структуры хроматина принимает участие ДНК в комплексе с гистонами, негнстоновыми белками и небольшим количеством РНК- Существует мнение, что хромосомные белки выполняют не только структурную функцию, но и регуляторную, облегчая или затрудняя транскрипцию' определенных генов хроматина с помощью ДНК-зависимой РНК-полимеразы.
Гистоны,, как оказалось, являются негативными регуляторами транскрипции (подобно репрессорам у бактерий). Они, имея положительный заряд, связываются с отрицательно заряженными фосфатами ДНК и блокируют транскрипцию, т. е. не дают использовать участки ДНК в качестве матрицы для копирования. Деблокировка транскрипции (или дерепрессия) возможна, если ослабляется связь гистонов с ДНК. Помогают ослабить ее молекулы, нейтрализующие положительный заряд гистонов при связывании с ними, и модификация гистонов, которая изменяет их заряд и конфигурацию. Модн, фикацня гистонов происходит путем ферментативного присоединения фосфатных (фосфорилированиё гистонов), ацетильных (ацетилирование гистонов) и метильных (метилирование гистонов) групп. При модификации • гистонов облегчается транскрипция и увеличивается ДНК-зависимый синтез РНК-
Очевидно, гистоны участвуют в регуляции транскриптонов хроматина, однако они не могут обеспечить специфичность регуляции генов, так как их число ограничивается всего пятью молекулами (трудно предположить, чтобы всего пять гистонов могли избирательно регулировать транскрипцию столь разнообразных генов). Видимо, регуляторные функции гистонов не- специфичны или специфичны для каких-то однотипных транскриптонов, например для рРНК и тРНК-
Негистоновые белки более разнообразны (насчитывается около 500— 600 фракций негистоновых белков), поэтому считается, что они играют роль специфических регуляторов транскрипции. Негистоновые белки, как правило, несущие отрицательный заряд, могут тем не менее связываться непосредственно с ДНК, причем не вообще с любыми ее участками, а специфически. Негистоновые белки являются позитивными регуляторами, так как облегчают транскрипцию в месте связывания с ДНК. Правда, еще неясен молекулярный механизм включения транскрипции негистоновыми белками. Особенно эффективно активируют транскрипцию фосфорилированные негистоновые белки Приобретая больший отрицательный заряд, они нли образуют комплекс с положительно заряженными гистонами, оттесняя их в данном участке от ДНК, или дестабилизируют молекулу ДНК, в^аимидейчвуя непосредственно с ней. В том и другом случае транскрипция облегчается
Третий тип регуляторов транскрипции — молекулы низкомолекулярной стабильной ядерной РНК (векторной РНК), которые находятся в ядре (не покидая его) в комплексе с белком (РНП). Такой рибонуклеопротеид включает избирательно гены путем комплементарного взаимодействия с акцепторными участками транскриптонов. Регуляторная функция этиХ молекул изучается.
Схема регуляции белкового синтеза
Регуляция синтеза белков у эукариотов может осуществляться на уровне транскрипции и трансляции. В первом случае проявляется избирательность действия разных регуляторов на отдельные гены, а с ним и специфика регуляции метаболизма клетки, который как раз определяется набором соответствующих белков. Регуляция на уровне трансляции больше отражается на скорости синтеза отдельных белков в рибосомах, чем на их составе, ибо при трансляции лишь механически воспроизводится программа мРНК.
Механизм действия индукторов представляется следующим образом. Индукторы (например, гормоны) поступают в ядро и взаимодействуют с молекулами-регуляторами транскрипции или активируют их модификацию. Тем самым различные индукторы могут включать «свои» гены в разных участках хромосом путем инактивации репрессорного действия гистонов (за счет прямого связывания с ними или активирования ферментов, осуществляющих их фосфорилирование, ацетилирование или метилирование) или модификации (например, с помощью фосфорилироваиия) негистоновых белков, или посредством взаимодействия с векторными РНП. Возможны и другие пока неизвестные механизмы, в частности прямое взаимодействие индуктора с участком ДНК. Любой из этих механизмов облегчает связывание РНК- полимеразы с промотором и образование РНКовых копий транскрнптона.
Интересно, " что при действии индукторов белкового синтеза, например гормонов, транскрипция генов рРНК и тРНК несколько опережает транскрипцию с участков ДНК, содержащих информацию о структуре специфических белков. В этом имеется определенная целесообразность: сначала увеличивается мощность аппарата для сборки белка (тРНК, рРНК и рибосомы), а затем поступает мРНК для реализации синтеза белка.
После прекращения действия индуктора происходит отщепление модифицирующих групп от гистонов, и гистоны, вновь соединяясь с ДНК, прекра- 324 щают транскрипцию. Негистоновые белки претерпевают аналогичные изменения; они вновь связываются с хроматином, а часть их подвергается распаду и заменяется новыми молекулами, поступающими из цитоплазмы.
В отличие от прокариотов у эукариотов блокада транскрипции не означает прекращения синтеза белка. У эукариотов более стабильны молекулы мРНК, которые у прокариотов быстро гидролизуются. Консервация мРНК у эукариотов дает возможность использовать ее в качестве матрицы для сборки белка в рибосомах и после того, как образование новых копий мРНК при транскрипции заблокировано.
Регуляция синтеза белка на уровне трансляции возможна путем действия регуляторов на белковые факторы, контролирующие в рибосомах инициацию, элошацию и терминами*»трансляции, и на. различные функциональные участки рибосом.
Негенетическая регуляция количества белка в клетках
Количество белка зависит не только от скорости его синтеза в клетках, но и от скорости его распада, т. е. обновления. Есть белки, которые недолго существуют после синтеза. Например, полупериод жизни (т. е. время, за которое распадается половина данного вещества) синтетазы б-аминолевуленовой кислоты составляет около часа, лактатдегидрогеназы — около 16 дней, аль- долазы и гликогёнфосфорнлазы — около 50 дней, а эластин — гликопротеид соединительной ткани — образуется только эмбриональными фнбробластами и, очевидно, не обновляется.
Все вещества, которые повышают стабильность белков (кофакторы, - субстраты и др.), сохраняют продолжительность их жизни, что ведет к увеличению, количества белка. Это явление увеличения количества белка за счет повышения стабильности его молекул или снижения распада получило название субстратной или негенётической индукции (хотя индукции как таковой здесь не наблюдается). Процесс регуляции количества белков в клетке играет большую роль, и его нужно учитывать при оценке действия природных регуляторов и лекарств, которые могут больше влиять именно на фазу распада белков, чем на их синтез.
3. Нематричный синтез белка
Как уже говорилось, нематричный синтез белка неэкономичен и громоздок, поскольку для образования каждой новой пептидной связи требуется отдельный фермент. В клетках прокариотов имеются полиферментные системы для синтеза коротких полипептидов, например грамицидина и некоторых других полипептидных антибиотиков. У эукариотов нематричный синтез описан для дн- и трипептидов. Например, таким способом образуются дипеп- тиды — карнозин и ансерин, и трипептид глутатион, являющийся коферментом ряда окислительных ферментов.
4. Препараты, влияющие на синтез белка Препараты, влияющие на синтез белка, широко используются в практике. Индукторы применяются с целью стимуляции синтеза белка в поврежденных
или ослабленных длительным бездействием (атрофичных) органах. Этот эффект индукторов облегчает восстановление функций клеток пораженного органа.
Ингибиторы синтеза белка применяются в противоположных целях: для подавления деления и роста клеток.
Препараты, усиливающие синтез белка. Препараты этой группы являются индукторами синтеза белка и относятся к так называемым анаболическим средствам. Анаболические средства бывают гормональные и негормональные. Наиболее обширна группа препаратов гормональной природы. Среди них наиболее выраженной способностью к индукции синтеза белка (действуя на уровне транскрипции) обладают анаболические стероиды (метандростено- лон, феноболин и самый активный ретаболил), являющиеся производными мужских половых гормонов (андрогенов) и применяющиеся только с целью стимуляции синтеза белка в организме. Выраженной анаболической активностью обладает инсулин, причем этот белковый гормон, очевидно, активирует синтез белка на уровне трансляции.
К не гормональным анаболическим средствам, получившим применение в практике, относятся предшественники нуклеотидов и нуклеиновых кислот. Например, оротат калия (оротовая кислота является ключевым соединением в биосинтезе пиримидиновых нуклеотидов), инозин (или гипоксзнтинрибо- зид). Механизм анаболического действия, очевидно, связан не только с использованием их как структурного материала для синтеза нуклеиновых кислот, но главным образом с тем, что они сами или ближайшие их продукты обмена служат индукторами синтеза белка. Возможно, таким образом действуют и другие промежуточные продукты обмена нуклеотидов и нуклеиновых кислот.
Ингибиторы синтеза белка — более обширная группа препаратов, используемая при биохимических исследованиях и в практической медицине. Все ингибиторы синтеза белка можно разделить на ингибиторы: а) транскрипции; б) процессинга и транспорта РНК, " в) трансляции. Хотя некоторые препараты действуют на несколько этапов переноса генетической информации
Ингибиторы транскрипции п<? механизму делятся на три группы: ингибиторы ДНК-зависимых РНК-полимераз, блокирующие ДНК- матрицу и искажающие информацию синтезируемой РНК.
В качестве примера препаратов первой группы можно назвать: а-амани- тин (яд бледной поганки), избирательно ингибирующий РНК-полнмеразу Ш (ответственную за транскрипцию мРНК); антибиотики рифамицины, блокирующие ядрышковую РНК-полимеразу I (отвечает за транскрипцию рРНК) и обратную транскриптазу. а-Аманитин используется при биохимических исследованиях, а рифамицины—как антибактериальные прелзраты'в медицинской практике.
Ко второй группе относятся вещества, связывающиеся нековалентно с матрицей ДНК и мешающие работе РНК-полимер азы. Например, актиноми- цин D (используется в биохимических исследованиях), а также антибиотики оливомицин, дактиномицин и растительные алкалоиды винбластин и вин- кристин, которые применяются в медицине как противоопухолевые препараты.
К третьей группе можно отнести, например, 5-фтороурацил, включающийся в мРНК вместо природного нуклеотида и приводящий в негодность синтезируемую матрицу РНК-
Ингибиторы процессинга и транспорта мРНК- Потенциальными ингибиторами синтеза белка на этом этапе могут быть ингибиторы внутриядерных РНКаз, РНК-лигаз, осуществляющих различные фазы созревания мРНК- Препятствует присоединению полиаденилового фрагмента к мРНК кордицепин (3-дезоксиаденозин), который можно назвать ингибитором транспорта мРНК, поскольку полнадениловый фрагмент облегчает транспорт ее из ядра в цитоплазму.
Ингибиторы трансляции (т. е. синтеза белка в рибосомах). В качестве примера можно назвать антибиотики, применяемые как антибактериальные препараты.
Хлорамфеникол действует на бактериальные 70S рибосомы и рибосомы митохондрий и хлоропластов эукариотов (на 80S рибосомы он не влияет). Хлорамфеникол связывается с 50S субчастицей рибосом и блокирует пепти- дилтрансферазную реакцию, вызывая преждевременный обрыв синтезируемой полипептидной цепи.
Линкомицин близок к действию хлорамфеникол а на 80S рибосомы.
Эритромицин (и другие антибиотики макролиды) ингибирует транслокацию пептидил-тРНК из участка А в П-участок 50S субъединнцы бактериальных рибосом (т. е. блокирует третий шаг элонгации трансляции).
Тетрациклины более избирательно влияют на 70S, чем на 80S рибосомы. Блокируют связывание мРНК и аминоацил-тРНК с малой субчастицей рибосом, т. е. фазу инициации и элонгации' синтеза белка в рибосомах.
Стрептомицин влияет на 70S рибосомы бактерий и не оказывает действия на 80S рибосомы. Специфически связывается с белком малой субчастицы и нарушает правильное считывание мРНК. Синтез белка при этом прекращается или образуется дефектный белок, не способный функционировать.
В лабораторных исследованиях применяется циклогексимид (актидион)к действующий исключительно на 80S рибосомы эукариотов. Он связывается с большей субчастицей рибосом и тормозит транслокацию. В высоких концентрациях блокирует РНК-полимеразу I, т. е. действует на транскрипцию.
ГЛАВА 25. МОЛЕКУЛЯРНАЯ ПАТОЛОГИЯ
1. Нарушения переноса генетической информации
Изменения генетического кода. Изменения генетической программы ДНК клеток называются мутациями. Различают хромосомные мутации (изменение числа хромосом, хромосомные аберрации) и молекулярные, или генные, мутации.
Существуют следующие варианты генных мутаций:!) транзиция, или замена пар оснований,
2) делеция, или выпадение одной пары или групп пар оснований (нуклеотидов);
3) вставка одной пары или групп пар оснований (нуклеотидов), -
4) изменение местоположения отдельных участков ДНК- Генные мутации вызывают изменения генетического кода, нарушая порядок чередования нуклеотидов в ДНК и функцию транскриптонов. Если изменения происходят в структурных генах, то может образоваться дефектный белок, не способный полностью или частично выполнять свою функцию в зависимости от того, как изменившийся порядок чередования аминокислот в полипептидной цепи отразится на трехмерной структуре белка. Мутации, в структурных генах РНК могут привести к образованию дефектных тРНК и рРНК, что скажется на осуществляемых ими функциях (узнавании и транспорте соответствующих аминокислот и сборке рибосом).
Мутация 2 промоторе нарушают связывание РНК-полимеразы. что б конечном счете приводит или к недостаточному образованию нормального белка, или к полному прекращению его синтеза. Мутации в акцепторной зоне (операторе у прокариотов) приводят к переходу от регулируемого синтеза индуцируемого белка к нерегулируемому, т. е. конститутивному.
Мутации бывают спонтанными и вызванными различными факторами. Спонтанные ошибки очень редки. При репликации они-составляют оцин ошибочный нуклеотид на 10~fi—10~9 нуклеотидов, при транскрипции — на Ю-— 10~6 и при трансляции — на Ю-4 нуклеотидов. Факторы, вызывающие мутации, называются мутагенами. Бывают природные мутагены, повышающие частоту спонтанных мутаций, и чужеродные. К природным относятся пероксидные соединения, альдегиды, свободные радикалы и т. д. К чужеродным мутагенам относятся как химические вещества (алкилирую- щие соединения, азотистая кислота, гицроксиламин, окислители и многие другие), так и физические (ионизирующие излучения) и биологические факторы (например, вирусы способствуют образованию в клетке энзимов, повреждающих ее ДНК).
Генетические нарушения и окружающая среда. Мутагены окружающей среды чрезвычайно многочисленны, что приводит к постоянному накоплению в последующих поколениях наследственных болезней. Высокой мутагенной активностью обладает радиоактивное излучение. Фоновая радиация среды постоянно повышается, за последние 30 лет она возросла на 10%, что увеличило частоту мутаций у людей. В мире рождается до 15 000 детей с генетическими дефектами только из-за испытаний ядерного оружия в атмосфере. Поэтому борьба за запрещение ядерного оружия является борьбой за здоровье будущих поколений.
Загрязнение окружающей среды различными химическими отходами промышленных предприятий, химическими средствами защиты растений (применяемыми в сельском хозяйстве) отрицательно сказывается на генетической программе всех живых организмов. В настоящее время пересматривается безвредность пищевых добавок. Некоторые пищевые добавки' (консерванты, вкусовые вещества и т. д.) оказались мутагенами, поэтому проходят подробное испытание на мутагенную активность.
Многие лекарственные средства могут обладать выраженной мутагенной активностью и поэтому должны быть «просеяны» через сито предварительных генетических испытаний. Попытки использовать препараты без обстоятельной проверки на мутагенную активность обернулись в ряде капиталистических стран подлинной катастрофой. Особенно опасно применение химических лекарственных веществ в период беременности, поскольку, проникая через плаценту, они могут вызвать пороки эмбрионального развития, уродства (подобное действие препаратов называется тератогенным, т. е. способным вызвать уродства).
Для предотвращения отрицательного мутагенного влияния препаратов в СССР организованы в государственных масштабах всесторонние испытания лекарственных веществ на тератогенную активность и ограничены показания к назначению лекарств в период беременности. Накопленный материал свидетельствует о том, что многие снотворные, наркотические и успокаивающие средства в лечебных дозах не обладают мутагенным влиянием на клетки плода. Не предатавляют опасности антибиотики, сульфаниламиды, витаминные препараты в терапевтических дозах. Возможен риск проньленин гематогенного действия у противоопухолевых препаратов, частично у кортикостерои- дов и антигистаминных средств. Всесторонняя работа по охране генетической программы человека станет одним из обязательных условий дальнейшего социального прогресса.
2. Молекулярная патология
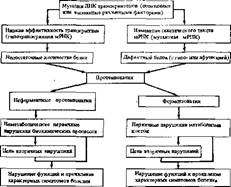
Понятие «молекулярная патология» или «молекулярные болезни» было введено в 1949 г. Полингом. Появление его было связано с успехами молекулярной генетики, в частности с раскрытием тайны причин заболевания, называемого серповидноклеточной анемией. Под молекулярными болезнями принято понимать заболевания, основной причиной которых является генетически, обусловленное нарушение функции белков. Иными словами, молекулярная болезнь развивается вследствие образования или дефектного белка (полностью или частично утратившего свои функции), или-явно недостаточного количества нормального белка, не способного из-за этого выполнять в полном объеме свои функции в организме. Молекулярные болезни по существу можно назвать протеинопатаями, т. е. «болезнями» специфических белков.
Протеинопатии можно разделить на две большие группы: ферментные (фермёнтопатии, или энзимопатии) и неферментные. Первая группа связана с дефектами ферментных белков, приводящими к нарушению определенного звена метаболизма, а вторая — с дефектами неферментных белков, выполняющих прочие функции, например транспортную, рецепторную, иммунологическую и т. д. Это приводит к нарушению конкретных процессов, зависящих от данного неферментного белка. Возможна и смешанная протеинопатия, если поврежденный белок совмещает каталитические и какие-либо другие функции.
Внешние проявления, так называемые манифестные признаки, протеино- патий зависят прежде всего от степени нарушения функциональных способностей данного белка и значимости выполняемых им функций для жизнедеятельности клеток организма. Цепь вторичных проявлений нарушенных функций белка дезорганизует метаболизм клеток, тканей и органов, что приводит к формированию болезненного состояния организма в целом с присущими данной болезни симптомами (схема 5).
Схем a S, Развитие молекулярных болезней
|
Понятие о фериентопатиях, или «врожденных» нарушениях обмена веществ, упоминалось еще в 1909 г. Гарродом. Важнейшим признаком фермен- топатий является блокированиецепи и превращений веществ, вызванное недостаточностью фермента. Например, в клетке происходит цепь превращений субстратов (из А в D), катализируемых ферментами (Е,, Е2, Е3):
Недостаточность, например, Е2 блокирует эту цепь превращений, что приводит к метаболической ситуации, когда содержание веществ до блока повышается, а после него уменьшается (или они вообще не образуются):
е2
блок
Болезнь развивается только в следующих случаях.
1. Если накопившееся вследствие блокады фермента вещество В токсично для клеток или накопление его столь велико, что оно занимает значительную часть внутриклеточного пространства и является как бы механиче-
Фенилаланин им > Тирозип > 3, 4-Дигидрокснфенилалашш
' t еЬ:
Фенплпируват Гидроксифеиилпируввт Меланин
/ ^1... Фенпдлактат Фенила цетат
Алкаптон
Гомогкнтнзиновая
кисиота
Фу ые рилаце»оу к сусная
" Т
со2 + Н20
Рис. 71. Схема генетических нарушений обмена фенилаланина и тирозина
в тканях организма' /—фенил него иурня (дефект феиилаланянгидроксилазы); Ч — альбинизм (дефект тнроэинаэы), iii — тирозинения (дефект п-гидроксифенилпируватоксндаэы);
iv — алкаптонурня (дефект гомогеитнэннатоксидааы)
ской помехой для осуществления специфических функций клеток. Подобное избыточное накопление (болезни накопления) возможно только для макромолекул, не способных покинуть клетку путем диффузии.
2. Если вещества (С и D), которые не могут образоваться из-за блокады фермента, жизненно важны для клеткй и не могут синтезироваться другим (окольным) путем.
Во всех остальных ситуациях — когда накапливающиеся метаболиты нетоксичны или дефицит веществ, возникающий в результате блокады химических превращений, может быть восполнен или заменен, ферментопатия не приводит к развитию молекулярной болезни'. Она протекает бессимптомно и обнаруживается при обследовании случайно.
Рассмотрим некоторые примеры молекулярных болезней, связанных с дефектами конкретных ферментов.
Ферментопатин аминокислотного обмена
Нарушения обмена фенилаланина и тирозина. Наиболее часто встречается четыре вида молекулярных болезней, связанных с обменом фенилаланина и тирозина. Причиной их являются блоки на разных этапах обмена этих аминокислот (рнс. 71).
Фенилкетонурия, или фенилпировиноградная олигофрения (рис. 71, /), — молекулярная болезнь, связанная с дефектом фенилаланингидрок- с и л а з ы. При этом заболевании наблюдается блокада превращения фенилаланина в тирозин. Вследствие этого накапливаются фенилаланин и продукты его превращений — фенилпнруват, фениллактат и фенилацетат. Повышается содержание этих веществ в крови и выделение их с мочой. Обычно заболевание выявляют по повышению фенилаланина в крови и фенилпировиноградной кислоты в моче.
Предполагают, что фенилпировиноградная кислота или сама является токсическим соединением для клеток мозга, или, накапливаясь, действует на обмен других важных для деятельности нервной системы веществ (например, серотонина, содержание которого снижается). В результате у детей с этой ферментопатией развивается тяжелое отставание умственного развития (слабоумие), приступы cyAQpor.
Альбинизм (рис. 71, //) — молекулярная болезнь, связанная с дефектом тирозиназы. При этой ферментопати'и нарушено превращение диокси- фенилаланина (ДОФА) в ДОФА-хинон и далее в меланин (пигмент черного цвета). Меланин находиich в коже, волосах, радужке и пигментном эпителии сетчатки глаза и определяет их окраску. Характерными признаками этого заболевания являются слабая пигментация кожи, светлые волосы, красноватый цвет радужки глаз (из-за просвечивающих капилляров). Серьезных нарушений это состояние не вызывает. Лишь приходится избегать прямого солнечного света.
Тирозинемия (рис. 71, III) — ферментопатия, связанная с дефектом п-г идроксифенилпируватоксндазы. При этом заболевании не образуется гомогентизиновая кислота из предшественников, вследствие чего содержание тирозина и n-гидроксифенилпировиноградной кислоты в крови и выделение их с мочой повышается. У детей, больных тирозинемией, " наблюдается отставание в развитии.
Алкаптонурия (рис. 71, /V) — ферментопатия, связанная с дефектом гомогентизинатоксндазы. При этой болезни нарушено окисление гомогентизиновой кислоты в тканях, вследствие чего содержание ее в жидкостях организма и выделение с мочой повышается. В присутствии кислорода гомогентизиновая кислота полимеризуется с образованием черного пигмента — алкаптона. Поэтому моча таких больных тут же на воздухе темнеет (у детей пеленки окрашиваются в черный цвет). Алкаптон может образоваться и в биологических жидкостях, оседая в тканях, коже, сухожилиях, хрящах носа, ушей и суставов. При значительных отложениях пигмента в суставах наблюдаются нарушения их подвижности.
Гомоцистинурия — ферментопатия, связанная с недостатком ци статно н и н-Р-с и н т а з ы, что препятствует превращению гомоцистеина в цис- татионнн. Гомоцистеин накапливается в тканях, в крови и выделяется с мочой в повышенных количествах. У детей при этом заболевании наблюдаются задержка умственного развития, периодические судороги.
Гистидинемия — заболевание, связанниое с дефектом гистидазы, катализирующей окислительное дезаминироваиие гистидина. Наблюдается выраженное повышение содержания гистидина в крови и частично в моче. При этой молекулярной болезни наблюдается поражение функций центральной нервной системы (судорожные явления, шатающаяся походка).
Кетонуряя разветвленных аминокислот, или болезнь «моча с запахом кленового сиропа», является следствием недостаточности декарбокси- лазы кетопроизводных разветвленных аминокислот, т. е. валина, лейцина и изолейцина:
валин | аиииотрен«ф«ра.ш а-КСТОКНСЛОТЫ двхзрбохсилаэы ПрОНЗВОДНЫе
.пейцнн I-------------------- *- разветвленных»- кетокислот,
изолейшш f аминокислот 1& лок! связанные с КоА-®'
332 ' '-- 1
В результате нарушения окислительного декарбоксилирования происходит повышение содержания в крови разветвленных аминокислот и их кетопро- изводных, а также выделение их с мочой. Моча таких больных имеет характерный запах кленового сиропа. Клинически у такйх детей наблюдается рвота, периодические судороги, слепота, мышечная ригидность..
Таблица 28. Классификация заболеваний, вызванных нарушениями в обмене гликогена (по Е. J1. Розенфельд)
Увеличение печени (гепатоме- галия); отставание в росте, развитии: гипогликемия, сопровождающаяся судорогами; гипергликемия, к его нем ия и ке- тоиурия
'Увеличение сердца (кардиоме
но нарастающей сердечно легочной недостаточяостью.1 Смертельный исход наступает в детском возрасте Клинические признаки сходны с болезнью Гирке (особенно при печеночной форме), но менее выряжены
| Печень, се- шцы, яерв- лейкоциты Печень, мы- лейкоциты Печень, милей коциты |
| Генералнзо- щечная Печеноч на я, генерал hso- |
Гепатомегалня и спленомега- лия, нарастающая печеночная
Прогрессирующая м иопати я и болезненные судороги мышц еле физических упражнений фоне быстрой общей утом- емости (вследствие парушен- й мобилизации гликогена
I1UU)
Гепатоыегалия с умеренной ги-' погликемией, кетои^мней и аин-
Мыщечная слабость, особенно рн повышенных мышечных агрузках Болевые ощущения в мышцах при физической нагрузке (напоминает клияичеснуад картину болезни Мак-Ардля) Клиническая картина сходна с болезнью Хере а Гепатомегалия (но без призна
| («яетяящий фермент») Фосфорила- |
| Печеночиая, Печеночная, Мышечная Печеиочиля Печеночная. |
| Киназа фосфор ил азы В Протеинкн- |
| Печень, ыы- |
Гипогликемия с судорогами, жемия, рвота, нарушение умственного развития
Ферментопатии углеводного обмена
Глнкогенозы. Довольно часто встречаются ферментопатии, связанные с нарушением обмена гликогена, что выражается или в накоплении гликогена в органах (болезни накопления), или в его отсутствии. Ферментопатии, вызывающие накопление гликогена, называются гликогенозами, а препятствующие его депонированию — агликогеноэами. В зависимости от места преимущественного отложения гликогена существует три формы болезни: печеночная, мышечная и генерализованная (т. е. гликоген накапливается почти во всех органах). Вследствие накопления гликогена происходит «механическое» нарушение функций данных тканей и органов и развивается гипогликемия в тех
ний, связанных с нарушением обмена гликогена, и их краткая характеристика приведены в табл. 28.
Галактоземии — молекулярная болезнь, вызванная дефектом галактозо- 1-фосфат-уридилтрансферазы. Это приводит к накоплению галактозо-1-фос- фата, в норме быстро превращающегося в уридиндифосфатгалактозу и далее по путям превращения глюкозы. Галактозо-1-фосфат токсичен для организма. Поскольку галактоза, входящая в лактозу, потребляется в больших количествах ребенком с молоком матери, то при наличии ферментопатии у него быстро накапливается токсическое производное галактозы. Ребенок теряет в весе, замедляется его умственное и физическое развитие, увеличивается печень, развивается помутнение хрусталика глаза. Если не приостановить кормление молоком, то дети обычно погибают. У таких больных необходимо исключить из пищи галактозу.
Ферментопатии липидного обмена
Заболевания, вызванные нарушениями липидного обмена, принято называть липидозами. Большинство липидозов являются ферментопатиями, имеющими генетическую природу. Большинство липидозов проявляются в виде болезней накопления, т. е. в клетках или жидких средах организма обнаруживается ненормально большое количество липидов, связанных с дефектом ферментов, расщепляющих соответствующие липиды (табл. 29).
Прочие ферментопатии
Фактически могут быть дефекты любого фермента, хотя не всегда они проявляются клинически. Например, акаталазия — болезнь, связанная с недостаточностью каталазы во всех тканях, у одних протекает тяжело (с язвами на слизистых), у других мало проявляется (очевидно, у них разложение пероксида водорода компенсируется другими ферментами).
Многочисленные молекулярные болезни, например, наблюдаются при дефектах белков системы свертывания крови, которые являются протеиназами. При генетическом дефекте их наблюдается нарушение свертывания крови
Неферментные протеи но пат и и
Гемоглобинопатии являются классическим примером неферментных протеино- патий, связанных с генетическим дефектом субъединиц гемоглобина. Среди
Таблица 29. Примеры заболеваний, вызванных ферментопатия ми липидного обмена
|
них довольно широко распространено заболевание, названное серповидно- клеточной анемией. При этой болезни гемоглобин (HbS) отличается от нормального гемоглобина НЬА тем, что в HbS место глутаминовой кислоты (шестая аминокислота с N-конца в полипептидной цепи 0-субъединицы) занимает «алии. а-Субъединицы у HbS по составу те же, что и у НЬА. Следовательно, в структурном гене, кодирующем р-субъединицу гемоглобина, у больных сер- повидноклеточной анемией происходит мутация в шестом кодогене, выражающаяся в замене Т на А (т. е. транзиция):
Норма Се р nos идиохлеточ в ая
6-й кодоген ДНК — ЦТТ— —ЦАТ—
6-й *кодон мРНК —ГАА— —ГУА—
Оконца Глутаминовая Валнн
Подобная замена в полипептидной цепи сказывается на физико-химических свойствах гемоглобина. Валнн (неполярная аминокислота) придает меньшую растворимость дезоксигемоглобину, поэтому он образует крнсталлоподобиые структуры. Эритроциты при этом принимают форму серпа (отсюда и название болезни), становятся хрупкими, не способными выполнять функции по транспорту кислорода. Распад эритроцитов приводит к анемии (малокровию); капилляры, где оксигемоглобин отдает кислород, могут закупориваться эритроцитами, что ведет к омертвению участков тканей. Это заболевание можетпри- вести к неблагоприятному исходу.
Транспортные протеинопатии, связанные с дефектами белков, участвую- ших в транспорте веществ через мембрану, сопровождаются потерей клетками и организмом в целом данных веществ. Например, встречаются следующие наследственные заболевания.
Аминоацидурия — дефект белков одной из транспортных систем аминокислот в почках, где происходит их реабсорбция, сопровождается потерей их с мочой в 3—5 раз больше нормы.
Цистинурия — дефект белка, транспортирующего цистин, приводит к повышенному выделению с мочой преимущественно цистина и образованию цистиновых камней в почках.
Фруктозурия, глюкозурия и пентозурия, связанные с дефектом соответствующих мембранных транспортных белков в почках, сопровождаются потерей соответствующих моносахаридов (фруктозы, глюкозы или пентоз). Иногда эти протеинопатии называют почечным диабетом.
Возможны дефекты транспортных белков крови, и следствием этих дефектов является нарушение переноса соответствующих веществ (липидов, гормонов, витаминов и т. д.).
Врожденные дефекты образования антител, называемые агаммаглобули- немиямн, сопровождаются нарушением защитных реакций организма, связанных с недостатком антител.
3. Принципы лечения и профилактики молекулярных болезней По подсчетам специалистов ежегодно на земном шаре рождается около 16 млн. детей с наследственными дефектами. Многие из этих болезней протекают тяжело и заканчиваются смертельным исходом. Их лечение основывается на следующих принципах.
1. Частичное или полное исключение из пищи субстрата блокированной ферментной реакции. Подобный способ применяется, например, при лечении феинлкетонурии (бедная фенилаланином диета), галактоземии (исключение пищевой галактозы).
2. Обогащение пищи веществами, отсутствующими при нарушении собственного обмена. Например, при оротатацидурии нарушается синтез орото- вой кислоты — предшественника пиримидиков, что ведет к тяжелой мегалоб- ластической анемии. Обогащение пищи цитидиловой кислотой при этом заболевании позволяет обойти блок в обмене веществ и смягчить симптомы заболевания.
3. Обогащение организма кофакторами при дефекте апофермеита сложного* фермента. Этот способ применяется при врожденных нарушениях обмена витаминов. При дефекте апофермеита с ним хуже связывается кофермент н наблюдается недостаточность активного холофермента.. Преодолеть это состояние можно в ряде случаев введением значительных доз витаминов и коферментов.
4. Связывание и выведение из организма накапливающихся токсических продуктов метаболизма. Например, связывание накапливающейся в тканях меди при болезни Вильсона—Коновалова (дефект медьпереносящего 'белка — церрулоплазмина) и выведение ее нз организма.(путем введения пеницилл' амина).
5. Частичное «исправление» патологических белков путем их модификации. Например, введение веществ (цианата натрия или калия, ацетилсалициловой кислоты, цистеамина), вызывающих модификацию валина в HbS у больных- серповидноклеточной анемией, уменьшает осаждаемость -гемоглобина в эритроцитах и продлевает срок их службы.
6. Диетическое «исправление» дефекта обмена веществ. Эта пищевая коррекция\нарушенного обмена применяется при дефектах, связанных с нарушениями водно-солевого, кислотно-щелочного баланса, когда можно применять соответствующие солевые растворы или вещества, нормализующие кислотно-щелочной баланс.
7. Заместительное введение фермента, недостающего в организме. В принципе этот способ лечения применим для любой ферментопатии, хоти существуют трудности с получением очищенных ферментов и, главное, с методом введения их в организм. Сейчас разрабатываются специальные лекарственные формы—липосомы, в которые помещают фермент. Фермент захватывается тканями путем эндоцитоза. Можно также использовать трансплантацию тканей в качестве источника дефицитных ферментов.
8. Исключение внешних факторов, провоцирующих проявление молекулярной болезни. Многие лекарственные препараты усугубляют течение фер- ментопатий, поэтому применение их исключают при соответствующем заболе-
9. Использование генной инженерии, т. е. лечение путем пересадки нормального гена. Принцип подобного лечения в эксперименте разработан. Была сделана попытка использования этого метода в клинике при лечении больных Р-талассемией (дефект синтеза (J-субъединиц гемоглобина). Им был пересажен в клетки костного мозга ген, несущий информацию о структуре Р-цепи гемоглобина. Метод очень перспективен, но неясны результаты «поведения» пересаженных генов и векторов в клетках человека.
Профилактика молекулярных болезней зависит и от социальных мероприятий: охраны окружающей среды от загрязнений, прекращения использования отравляющих химических веществ, испытаний и применения радиационного оружия, выполнения правил техники безопасности при работе с источниками ионизирующего излучения, запрещения применения пищевых и лекарственных мутагенов и т. д.
Д. РЕГУЛЯЦИЯ И АДАПТАЦИЯ ОБМЕНА ВЕЩЕСТВ
В процессе жизнедеятельности клеткам приходится непрерывно приспосабливать свой обмен веществ к условиям внешней среды. Для управления обменом веществ существуют вещества-регуляторы, которые должны отвечать по крайней мере двум требованиям; служить неким индикатором изменений в обмене веществ и в то же время включать имеющиеся в клетках механизмы, регулирующие скорость и направление химических превращений. Как известно, скорость и направление биохимических процессов определяются фермерами клетки. Поэтому регуляторы могут направить в нужное русло биохимические процессы, влияя'на активность и количество ферментов, принадлежащих к разным путям обмена и находящихся в разных частях клетки. Отсюда становится понятным одно из важнейших качеств регуляторов: действуя в малых количествах, вызывать существенные сдвиги в метаболизме клеток.
В зависимости от продолжительности эффекта, произведенного регулятором на метаболизм, различают срочную и долговременную регуляции, в основе которых лежат совершенно разные механизмы. Срочная регуляция производит почти мгновенные изменения в обмене веществ. Механизм ее состоит е действии регулятора на транспорт веществ через мембраны (на транспортные системы мембран) и активность ферментов. Активность ферментов изменяется после воздействия регуляторов на их аллостерические или активные центры. Долговременная регуляция характеризуется длительными, устойчнзыми изменениями в обмене веществ и связана с влиянием ре1улитира на количество ферментов в клетке.
В зависимости от места действия регуляторы можно условно разделить на две большие группы: внутриклеточные и внеклеточные.
Внутриклеточные регуляторы образуются в клетке и влияют на активность и количество ферментов. У одноклеточных они образуются в ответ на изменения химического состава внешней среды или на поступление внутрь клетки, например, питательных веществ. У многоклеточных метаболизм отдельных клеток не автономен, а подчинен задачам целого организма. Поэтому в ходе эволюции у многоклеточных сформировалась целая группа внеклеточных регуляторов и регуляторных систем, которые координируют обмен веществ в разных тканях и органах целого организма. Развитие системы внеклеточных регуляторов повлекло за собой формирование воспринимающего их аппарата в рабочих (эффекторных) клетках. С этой целью в эффекторных клетках потребовались специальные белки-рецепторы (своеобразные биологические «антенны» для приема внеклеточных регуляторов). Часть рецепторов была «вынесена» на внешнюю поверхность клеточной мембраны, чтобы различать регуляторы, не способные проникнуть сквозь нее. Другая часть рецепторов локализована в цитоплазме, где они взаимодействуют с проникающими внутрь клеток внешними регуляторами.
К внутриклеточным регуляторам можно отнести:
1) питательные вещества и метаболиты;
2) витамины и образующиеся из них коферменты;
3) группу внутриклеточных посредников — циклические нуклеотиды (цАМФ, цГМФ и, возможно, другие), ионы Са2+ и олигонуклеотиды, например 2', 5'-олиго-(А).
У млекопитающих питательные вещества и метаболиты служат регуляторами главным образом активности ферментов. Генетическая регуляция ими количества ферментов строго не доказана.
Витамины являются смешанными регуляторами, они регулируют активность ферментов (как компоненты активного центра), а часть из них, особенно жирорастворимые витамины, действуют подобно внеклеточным регуляторам активности и количества ферментов.
Группа внутриклеточных посредников, как правило, не имеет самостоятельного значения. Их «запуск» осуществляется внеклеточными регуляторами
Внеклеточные регуляторы отличаются местом образования и биологическими свойствами. В организме человека и животных различают: гуморальную, эндокринную и нервную системы регуляции.
• Гуморальная система регуляции характеризуется тем, что химические вещества-регуляторы образуются во внеклеточных жидкостях, действуя на клетки в месте своего образования, и, как правило, недолго. Эволюииоино это наиболее древние внеклеточные регуляторы многоклеточных. Для их образования используется простейший способ: отщепление от неактивной молекулы активного фрагмента-регулятора с помощью гидролитического фермента. Примером таких гуморальных регуляторов могут служить кинины (биологические активные полипептиды, образующиеся в результате гидролиза белков крови).
Эндокринная система регуляции отличается от гуморальной тем, что ее химические регуляторы образуются в специальных (эндокринных) клетках и органах и уже после этого достигают эффекторных клеток гуморальным путем (т. е. через биологические жидкости).
Для нервной регуляции характерен кабельный (электрический) способ передачи информации к эффекторным клеткам, действие на обмен и функцию которых происходит посредством медиаторов. Нервная регуляция отличается максимальной быстротой и целенаправленностью действующего сигнала. В организме нервная и эндокринная регуляции тесно связаны, поэтому их рассматривают как единую нейроэндокринную регуляцию.
ГЛАВА 26. ВИТАМИНЫ
1. Введение в витаминологию
Открытие витаминов было связано с изучением роли пищевых веществ в жизнедеятельности организма. В 1880 г. русский ученый Н.И.Лунин впервые доказал, что помимо известных составных частей пищи: белков, жиров, углеводов, воды и минеральных веществ — нужны какие-то дополнительные факторы, без которых организм не может нормально существовать. По предложению польского исследователя К. Функа, проводившего опыты по выделению нз рисовых отрубей активного начала (1911 —1912), эти дополнительные факторы пищи, были названы витаминами (в дословном переводе «амины жизни»), поскольку выделенное им из рисовых отрубей вещество содержало аминогруппу. С тех пор термин витамины укоренился в науке, хотя в химической структуре многих из них отсутствует аминогруппа и вообще азот.
Витамины — это необходимые для нормальной жизнедеятельности низкомолекулярные органические соединения, синтез которых у организмов данного вида отсутствует или ограничен.
Существует условное деление витаминных веществ на собственно витамины и витаминоподобные соединения. Последние похожи по биологическим свойствам на витамины, но требуются обычно в ббльших количествах. Следует напомнить, что не для любого организма одно и то же соединение служит витамином. Например, аскорбиновая кислота является для человека и морской свинки витамином, поскольку не синтезируется у них, а для крыс, кроликов, собак она не является витамином, так Как она синтезируется у них в тканях.
Источником витаминов у человека служат пища и кишечные бактерии. Последние сами синтезируют многие витамины и являются важным источником их поступления в организм.
В отличие от других пищевых веществ витамины участвуют в образовании коферментов, без которых невозможна нормальная функция соответствующих ферментов, или служат регуляторами биохимических процессов.
Классификация витаминов. По физико-химическим свойствам витамины делятся на две группы: жирорастворимые и водорастворимые. Для обозначения каждого из этих двух групп витаминов существует буквенное обозначение, химическое и физиологическое название (см. табл. 30). Отдельные витамины представляют собой группу близких по химической структуре соедине-
Таблица 30. Классификация витаминов и их производных
| Химические формы | ||||
| биологически не- | биологически активные | |||
| производные j коферменты | ||||
| А D Е К | Ретинол Кальциферолы Токоферолы Нафтохиноны | I.Жирораст ретиннлпальми- Эргокальцифе- рол (Dj), холе- кальциферол (D,) | воримые витамины Ретинол, ретн- наль, ретнное- ' вая кислота 1, 25-Дигид рок- си кальциферол а, ft, у, 6-Токоферолы, TOKO- триенолы и их эфнры Филохииои (К,), менахинон (К,) | Лнтиксеро- фтальмнческиЯ Антирахитиче- Антн стерильней Ант и геморрагический |