
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кінетика гальмування (інгібування) ферментативних реакцій
|
|
Відомо, що активність ферментів (швидкість ферментативної реакції) досить легко може зменшуватися за рахунок різноманітних впливів. Таке зниження називають гальмуванням активності, або інгібуванням ферментів.
Активність ферментів можна знизити або взагалі ліквідувати шляхом дій, які призводять до денатурації білків (нагрівання, вплив концентрованих кислот, солей важких металів тощо). Це неспецифічний вплив на активність ферменим, який має значення під час вивчення ферментативних реакцій, але не становить особливого інтересу для дослідження механізму дії ферментів. Значно важливішим є дослідження інгібування за допомогою речовин, які специфічно та, як правило, в невеликих концентраціях взаємодіють з ферментами.
За механізмом взаємодії з ферментами інгібітори поділяються на дві великі групи: інгібітори І, що вступають з ферментом Е в оборотну реакцію, яка за умов експерименту досягає рівноваги Е + І↔ ЕІ, та інгібітори, що реагують з ферментом необоротно, Е + І → ЕІ
Інгібітори, які знижують активність ферментів під час взаємодії з тими самими функціональними групами активних центрів, що й субстрати, називаються конкурентними. Інгібітори, що пригнічують активність ферментів унаслідок взаємодії з іншими функціональними групами, називаються неконкурентними. Ці назви свідчать, що у разі конкурентного гальмування інгібітор утворює неактивну спо  луку тільки з вільним ферментом Е + І↔ ЕІ або Е + І → ЕІ
луку тільки з вільним ферментом Е + І↔ ЕІ або Е + І → ЕІ
У разі неконкурентного гальмування інгібітор може реагувати з вільним ферментом і з ферментсубстратним комплексом;
Е + І↔ ЕІ, ЕІ + S↔ ЕІS або ЕS +І→ ІЕS.
Інколи інгібітор реагує тільки з ферментсубстратним комплексом і не реагує з вільним ферментом. На практиці часто спостерігається змішане гальмування, коли один і той самий інгібітор може реагувати з вільним ферментом у різних точках, а також з ферментсубстратним комплексом на різних стадіях його перетворення.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Під час конкурентного гальмування ступінь інгібування ферменту залежить не від абсолютної концентрації інгібітора, а від співвідношення концентрацій інгібітора та субстрату. Наприклад, за співвідношення концентрацій інгібітора та субстрату 1: 50 активність ферменту гальмується на 50 % незалежно від їх абсолютних концентрацій. За конкурентного гальмування односубстратної ферментативної реакції під впливом інгібітора в потрійній системі фермент - субстрат - інгібітор, встановлюється стаціонарний стан:
К-танта дисоціації комплексу фермент - інгібітор (ЕІ); 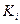 = [E][I]/[EI]. її називають також константою інгібітора.
= [E][I]/[EI]. її називають також константою інгібітора.
Конкурентне інгібування найкраще виявляється під час побудови графіка Лайнуївера-Берка, тобто графіків у координатах 1/v від 1/[S] за різних концентрацій інгібітора 1 - крива, яка одержана за наявності інгібітора; 2 - без інгібітора). Так, для конкурентного інгібування (рис. 7.10, а) одержують прямі лінії, що відрізняються між собою тангенсом кута нахилу та перетинають вісь ординат в одній точці. За наявності конкурентного інгібітора не змінюється значення Vmах, а уявне значення Кт більше, ніж її дійсне, на величину, що дорівнює різниці довжини відрізків, які відсікаються на осі абсцис. Таким чином, кінетичний аналіз за Лайнуївером-Берком свідчить, що конкурентні інгібітори збільшують величину константи Міхаеліса Кт ферменту і не впливають на максимальну швидкість ферментативної реакції Vmах. Зменшити дію конкурентного інгібітора можна при підвищенні концентрації субстрату в інкубаційному середовищі.
До конкурентних інгібіторів належать багато антиметаболітів, наприклад антивітаміни, алкалоїди, діаміни, які конкурують із субстратом у каталітичному центрі, завдяки схожості хімічної будови. Класичним прикладом конкурентного інгібування є гальмування сукцинатдегідрогенази малонатом та іншими дикарбоновими кислотами. На рис. 7.11, а наведено реакцію, яка каталізується сукцинатдегідрогеназою; на рис. 7.11, б- взаємодію сукцинату з активним центром ферменту, на рис. 7.11, в – конкурентні інгібітори, які схожі за будовою із сукцинатом: вони мають по дві ніжним чином розташовані у просторі негативно заряджені групи, які відповідають конформації активного центру сукцинатдегідрогенази.
За неконкурентного гальмування інгібітор зв'язується з ферментом не в тому місці молекули, де субстрат, тому що неконкурентні інгібітори не мають структурної спорідненості до субстрату реакції, яку він гальмує. Приєднання такого інгібітора знижує активність ферменту, а не його спорідненість із субстратом.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
До неконкурентних інгібіторів належать іони важких металів Сu2+, Hg2+, Ag 2+, що гальмують дію ферментів, які мають у своєму складі SН-групи. Неконкурентне гальмування ферментативної реакції відбувається за рахунок взаємодії інгібітора з вільним ферментом і з ферментсубстратним комплексом. Константу Кi неконкурентних інгібіторів можна також легко визначити через величину [I50]., тому що для цього виду інгібування Кi =[I50].Константа неконкурентного інгібітора не залежить від концентрації субстрату та субстратної константи.
Неконкурентне інгібування, як і конкурентне, найкраще виявляється на графіках Лайнуївера-Берка, що побудовані для різних концентрацій інгібітора. У разі неконкурентного інгібування графіки різняться за нахилом прямих (загальної точки перетину на осі ординат у них немає). Відрізок, який відсікається на осі ординат (І/v) під час інгібування, більший за неінгібований, що свідчить про зменшення \/mах за наявності інгібітора. Значення ж Кт залишається постійним.
Тангенс кута нахилу α = Кт / \/ mах, що відсікає відрізок на осі ординат, дорівнює. Тобто приєднання неконкурентного інгібітора до ферменту знижує швид кість реакції \/mах, але не впливає на спорідненість ферменту із субстратом.
Утворення комплексу ЕІ зумовлено виникненням ковалентних зв'язків з функціональними групами білка, які прямо або опосередковано беруть. участь у каталітичному процесі. Прикладом такого типу реакцій є взаємодія фосфорорганічних сполук ангідридної будови з деякими ацилгідролазами (естеразами).
|
|
