
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Ионные кристаллы
|
|
Такие вещества образуются с помощью химической связи, в основе которой лежит электростатическое взаимодействие между ионами. Ионная связь (по типу полярности – гетерополярная) в основном ограничивается бинарными системами типа NaCl (рис.1.10, а), то есть устанавливается между атомами элементов, которые обладают наибольшим сродством к электрону, с одной стороны, и атомами элементов, которые имеют наименьший потенциал ионизации, с другой. При образовании ионного кристалла ближайшими соседями данного иона оказываются ионы противоположного знака. При наиболее благоприятном соотношении размеров положительных и отрицательных ионов они касаются друг друга, и достигается предельно высокая плотность упаковки. Небольшое изменение межионного расстояния в сторону его уменьшения от равновесного вызывает возникновение сил отталкивания электронных оболочек.
Степень ионизации атомов, которые образуют ионный кристалл, часто такая, что электронные оболочки ионов соответствуют электронным оболочкам, характерным для атомов инертных газов. Грубую оценку энергии связи можно сделать, предполагая, что основная ее часть обусловлена кулоновским (то есть электростатическим) взаимодействием. Например, в кристалле NaCl расстояние между ближайшими положительными и отрицательными ионами составляет приблизительно 0, 28 нм, что дает величину потенциальной энергии, связанной с взаимным притяжением пары ионов, около 5, 1 эВ. Экспериментально определенное значение энергии для NaCl составляет 7, 9 эВ на одну молекулу. Таким образом, обе величины одного порядка и это позволяет использовать такой подход для более точных расчетов.
Ионные связи являются ненаправленными и ненасыщенными. Последнее сказывается в том, что каждый ион стремится приблизить к себе наибольшее количество ионов противоположного знака, то есть образовать структуру с высоким координационным числом. Ионная связь распространена среди неорганических соединений: металлы с галоидами, сульфиды, окислы металлов и др. Энергия связи в таких кристаллах составляет несколько электрон-вольт на атом, поэтому такие кристаллы имеют большую прочность и высокие температуры плавления.
Вычислим энергию ионной связи. Для этого напомним составляющие потенциальной энергии ионного кристалла:
кулоновское притяжение ионов разного знака;
кулоновское отталкивание ионов одного знака;
квантово-механическое взаимодействие при перекрывании электронных оболочек;
ван-дер-ваальсовское притяжение между ионами.
Основной вклад в энергию связи ионных кристаллов вносит электростатическая энергия притяжения и отталкивания, роль последних двух вкладов незначительна. Следовательно, если обозначить энергию взаимодействия между ионами i и j через  , то полная энергия иона с учетом всех его взаимодействий будет составлять
, то полная энергия иона с учетом всех его взаимодействий будет составлять
 . (2.40)
. (2.40)
Предоставим 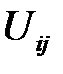 в виде суммы потенциалов отталкивания и притяжения:
в виде суммы потенциалов отталкивания и притяжения:
 , (2.41)
, (2.41)
где знак «плюс» берется в случае одинаковых, а «минус» – в случае разноименных зарядов. Полная энергия решетки ионного кристалла, который состоит из N молекул (2 N ионов), будет составлять
 . (2.42)
. (2.42)
При расчете полной энергии каждую взаимодействующую пару ионов следует учитывать лишь один раз. Для удобства введем следующий параметр  , где
, где  – расстояние между двумя соседними (разноименными) ионами в кристалле. Таким образом
– расстояние между двумя соседними (разноименными) ионами в кристалле. Таким образом
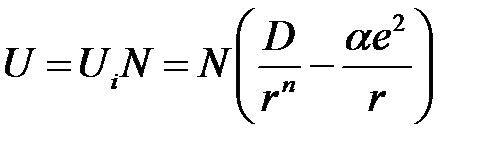 , (2.43)
, (2.43)
где постоянная Маделунга [4] α и постоянная D определяются следующим образом:
 , (2.44)
, (2.44)
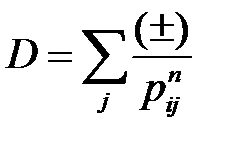 . (2.45)
. (2.45)
Сумы (2.44) и (2.45) должны учитывать вклад всей решетки. Знак «плюс» отвечает притяжению разноименных ионов, знак «минус» – отталкиванию одноименных ионов.
Постоянную 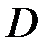 определим следующим образом. В равновесном состоянии полная энергия минимальна. Следовательно,
определим следующим образом. В равновесном состоянии полная энергия минимальна. Следовательно, 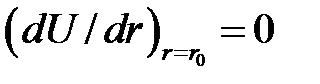 , и потому имеем
, и потому имеем
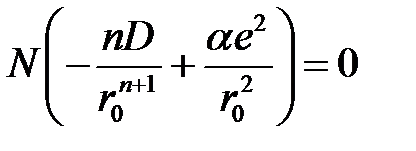 , (2.46)
, (2.46)
где 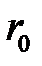 – равновесное расстояние между соседними ионами.
– равновесное расстояние между соседними ионами.
Из (2.46) получим
 , (2.47)
, (2.47)
и выражение для полной энергии кристалла в равновесном состоянии принимает вид
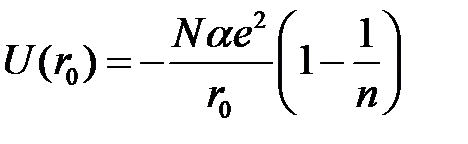 . (2.48)
. (2.48)
Величина 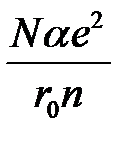 представляет так называемую энергию Маделунга. Поскольку показатель
представляет так называемую энергию Маделунга. Поскольку показатель  , то полную энергию можно практически полностью отождествлять с кулоновской энергией. Малая величина
, то полную энергию можно практически полностью отождествлять с кулоновской энергией. Малая величина 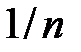 показывает, что силы отталкивания являются короткодействующими и резко изменяются с расстоянием.
показывает, что силы отталкивания являются короткодействующими и резко изменяются с расстоянием.
В качестве примера рассчитаем постоянную Маделунга для одномерного кристалла – бесконечной цепочки ионов противоположного знака, которые чередуются (рис.2.4).
| Рис.2.4. Одномерный кристалл |
Выбрав любой ион, например, знака «–» за начальный, будем иметь два иона знака «+» на расстоянии r 0 от него, два иона знака «–» на расстоянии 2 r 0 и так далее.
Следовательно, имеем
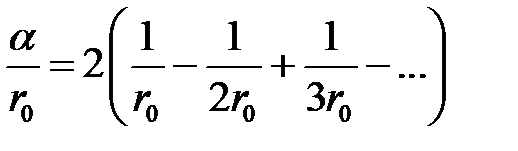 ,
,
или
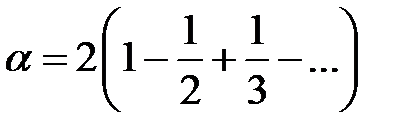 .
.
Воспользовавшись разложением в ряд 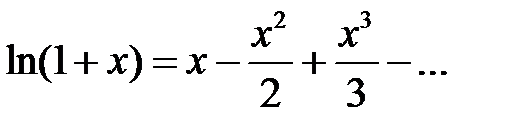 , получим в случае одномерного кристалла постоянную Маделунга
, получим в случае одномерного кристалла постоянную Маделунга
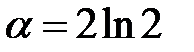 . (2.49)
. (2.49)
Таким образом, выражение для энергии, приходящейся на одну молекулу, принимает следующий вид
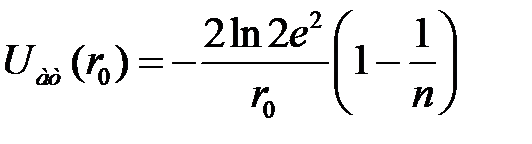 . (2.50)
. (2.50)
В случае трехмерного кристалла ряд сходится условно, то есть результат зависит от способа суммирования. Можно улучшить сходимость ряда, если выделить в решетке группы ионов таким образом, чтобы группа была электрически нейтральной, причем при необходимости делить ион между разными группами и вводить дробные заряды (метод Эвьена (Evjen H.M., 1932)).
Будем рассматривать заряды на гранях кубической решетки кристалла (рис.2.5) следующим образом: заряды на гранях принадлежат двум соседним ячейкам (в каждой ячейке заряд составляет 1/2), заряды на ребрах принадлежат четырем ячейкам (по 1/4 в каждом ячейке), заряды в вершинах принадлежат восьми ячейкам (по 1/8 в каждой ячейке). Вклад в α т первого куба можно записать в виде суммы:
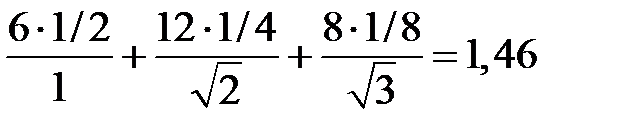
Если взять следующий по величине куб, который включает в себя рассмотренный нами, то получим  , что хорошо совпадает с точным значением для решетки типа
, что хорошо совпадает с точным значением для решетки типа 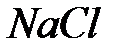 . Для структуры типа
. Для структуры типа 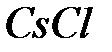 получено
получено  , для структуры типа
, для структуры типа  –
– 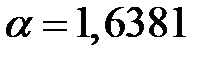 .
.
| Рис.2.5. Модель решетки с дробными зарядами для расчета суммы Маделунга по методу Эвьена |
Сделаем оценку энергии связи для кристалла 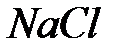 , допуская, что параметр решетки и модуль упругости В известны. Модуль упругости можно определить следующим образом:
, допуская, что параметр решетки и модуль упругости В известны. Модуль упругости можно определить следующим образом:
 , (2.51)
, (2.51)
где 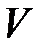 – объем кристалла. Объемный модуль упругости В является мерой сжатия при всестороннем сжатии. Для гранецентрированной кубической (ГЦК) структуры типа
– объем кристалла. Объемный модуль упругости В является мерой сжатия при всестороннем сжатии. Для гранецентрированной кубической (ГЦК) структуры типа 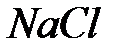 объем, который занимают молекулы, равняется
объем, который занимают молекулы, равняется
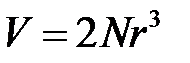 . (2.52)
. (2.52)
Тогда можно записать
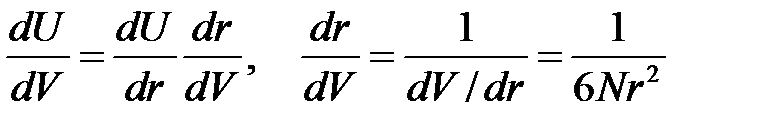 . (2.53)
. (2.53)
Из (2.53) легко получить вторую производную
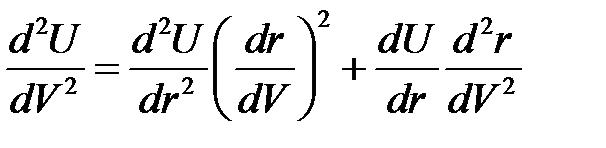 . (2.54)
. (2.54)
В состоянии равновесия первая производная обращается в нуль, следовательно, из (2.52–2.54) определим
 . (2.55)
. (2.55)
Воспользуемся (2.43) и получим
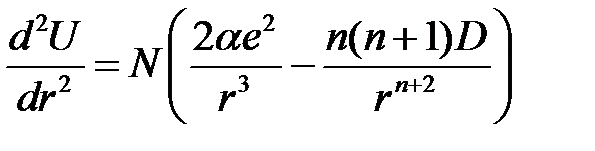 . (2.56)
. (2.56)
Из (2.47), (2.56) и (2.55) найдем объемный модуль упругости В:
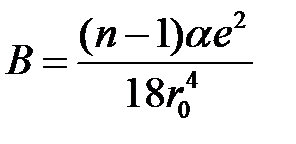 . (2.57)
. (2.57)
Выражение (2.57) позволяет вычислить показатель степени  в потенциале отталкивания, пользуясь экспериментальными значениями
в потенциале отталкивания, пользуясь экспериментальными значениями 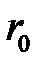 и
и 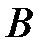 . Для кристалла
. Для кристалла 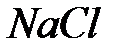
 ,
,  ,
,  . Тогда из (2.57) имеем
. Тогда из (2.57) имеем
 . (2.58)
. (2.58)
Заметим, что для большинства ионных кристаллов показатель степени n в потенциале сил отталкивания изменяется в пределах 6–10.
Следовательно, большая величина степени  обуславливает короткодействующий характер сил отталкивания. Воспользовавшись (2.48), вычислим энергию связи (энергия на одну молекулу)
обуславливает короткодействующий характер сил отталкивания. Воспользовавшись (2.48), вычислим энергию связи (энергия на одну молекулу)
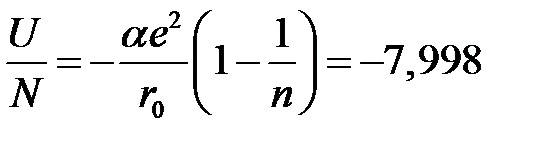 эВ/молекула. (2.59)
эВ/молекула. (2.59)
Это хорошо совпадает с экспериментальным значением -7, 948 эВ/ молекула. Следует помнить, что в расчетах мы учитывали только кулоновские силы.
Кристаллы с ковалентными и ионными типами связи можно рассматривать как предельные случаи; между ними располагается ряд кристаллов, которые обладают промежуточными типами связи. Такую частично ионную (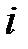 ) и частично ковалентную (
) и частично ковалентную (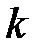 ) связь можно описать с помощью волновой функции
) связь можно описать с помощью волновой функции
 , (2.60)
, (2.60)
в этом случае степень ионности можно определить следующим образом:
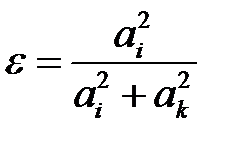 . (2.61)
. (2.61)
В табл.2.1 приведены некоторые примеры для кристаллов бинарных соединений.
Таблица 2.1. Степень ионности в кристаллах
| Кристалл | Степень ионности | Кристалл | Степень ионности | Кристалл | Степень ионности |
| SiC ZnO ZnS ZnSe ZnTe CdO CdS CdSe CdTe | 0, 18 0, 62 0, 62 0, 63 0, 61 0, 79 0, 69 0, 70 0, 67 | InP InAs InSb GaAs GaSb CuCl CuBr AgCl AgBr | 0, 44 0, 35 0, 32 0, 32 0, 26 0, 75 0, 74 0, 86 0, 85 | AgI MgO MgS MgSe LiF NaCl RbF | 0, 77 0, 84 0, 79 0, 77 0, 92 0, 94 0, 96 |
|
|